Часть II Параграф 32 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1



Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
Часть II
1. Запишите уравнения реакций получения азотной кислоты электродуговым способом:
N2 > NO > NO2 > HNO3
1) N2 + O2 > 2NO
2) 2NO + O2 > 2NO2
3) 4NO2 + O2 + 2H2O > 4HNO3
Почему способ так называется?
Способ называется электродуговым, потому что первая реакция идет при высокой температуре, достигающейся в электрическом дуговом разряде.
2. Запишите первое уравнение реакции получения азотной кислоты аммиачным способом:
N-3H3 + O02 > N+2O-2 + H2O-2
O02 + 4e > 2O-2 4 20 5 – окислитель, восстановление
N-3 - 5e > N+2 5 4 – восстановитель, окисление
4NH3 + 5O2 = 4NO + 6H2O
Чем этот способ отличается от электродугового?
Этот способ отличается от электродугового тем, что оксид азота (II) получают не в электрической дуге из азота, а каталитическим окислением аммиака.
3. Допишите уравнения реакций. Расставьте коэффициенты методом электронного баланса.
А) HN5+O3 (конц.) + Sn0 > Sn2+(NO3)2 + N02^ + H2O
2N5+ +10e > N02 10 10 1 – окислитель, восстановление
Sn0 - 2e > Sn+2 2 5 – восстановитель, окисление
12HNO3 (конц.) + 5Sn = 5Sn(NO3)2 + N2^ + 6H2O
Б) HN5+O3 (конц.) + I02 > HI+5O3 + N4+O2^ + H2O
N5+ + e > N4+ 1 10 10 – окислитель, восстановление
I02 - 10e > 2I+5 10 1 – восстановитель, окисление
10HNO3 (конц.) + I2 = 2HIO3 + 10NO2^ + 4H2O
4. Почему концентрированную азотную кислоту перевозят в стальных и алюминиевых цистернах? Концентрированную азотную кислоту перевозят в стальных и алюминиевых цистернах, потому что кислота пассивирует железо и алюминий.
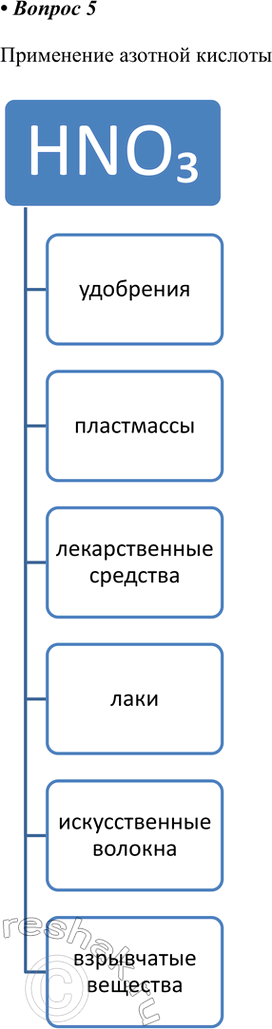
5. Заполните схему «Применение азотной кислоты».
6. Придумайте и решите задачу на нахождение объёма оксида азота(II), полученного путем взаимодействия разбавленной азотной кислоты с известной массой меди, содержащей долю примесей в виде оксида меди (II).
Какой объем оксида азота выделится при взаимодействии разбавленной азотной кислоты с 10 г меди, содержащей 10% примесей.
Дано:
m(Cu технич.)=10г
w(прим.)=10%
M(Cu)= 64 г/моль
Vm= 22,4 л/моль
V(NO)=?
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO^ + + 4H2O
w(Cu)=100% - w(прим.)= 100% - 10% = 90%
m(Cu)= m(Cu технич.) · w(Cu)/100%= = 10·0,9=9 (г)
n(Cu)=m/M=9/64=0,141 (моль)
V(NO)=n· Vm=0,094 ·22,4= 2,106 (л)
Ответ. 2,106 л.
7. Напишите синквейн об азотной кислоте.
Азотная кислота
Концентрированная и разбавленная
Бесцветная дымящаяся жидкость
Сильная кислота и сильный окислитель
Кислота
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.