Часть I Параграф 32 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1


Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
ОКСИДЫ АЗОТА
Часть I
1. Запишите формулы пяти оксидов азота и фигурными скобками объедините солеобразующие и несолеобразующие.
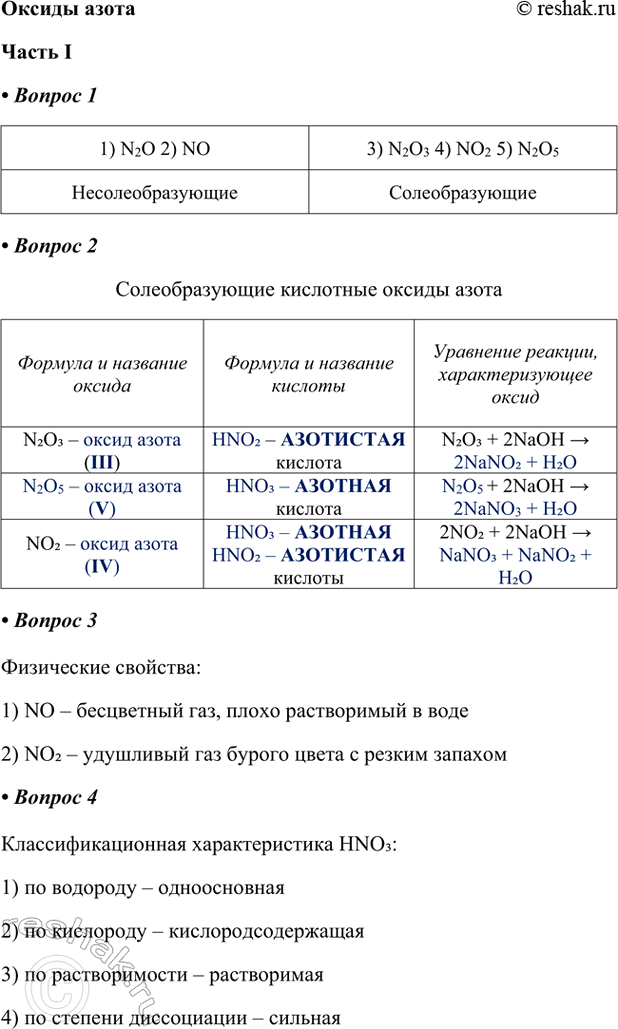
1) N2O 2) NO
Несолеобразующие
3) N2O3 4) NO2 5) N2O5
Солеобразующие
2. Заполните таблицу «Солеобразующие кислотные оксиды азота».
ФОРМУЛА И НАЗВАНИЕ ОКСИДА — ФОРМУЛА И НАЗВАНИЕ КИСЛОТЫ — УРАВНЕНИЕ РЕАКЦИИ, ХАРАКТЕРИЗУЮЩЕЕ ОКСИД
Формула и название оксида
N2O3 – оксид азота (III)
N2O5 – оксид азота (V)
NO2 – оксид азота (IV)
Формула и название кислоты
HNO2 – АЗОТИСТАЯ кислота
HNO3 – АЗОТНАЯ кислота
HNO3 – АЗОТНАЯ
HNO2 – АЗОТИСТАЯ
кислоты
Уравнение реакции, характеризующее оксид
N2O3 + 2NaOH > 2NaNO2 + H2O
N2O5 + 2NaOH > 2NaNO3 + H2O
2NO2 + 2NaOH > NaNO3 + NaNO2 + H2O
3. Физические свойства:
1) NO – бесцветный газ, плохо растворимый в воде
2) NO2 – удушливый газ бурого цвета с резким запахом
4. Классификационная характеристика HNO3:
1) по водороду – одноосновная
2) по кислороду – кислородсодержащая
3) по растворимости – растворимая
4) по степени диссоциации – сильная
5. Химические свойства HNO3 как электролита конкретизируйте уравнениями реакций в молекулярной, полной и сокращенной ионной формах:
1) 2HNO3 + CaO > Ca(NO3)2 + H2O
2H+ + 2NO3- + CaO > Ca2+ + 2NO3- + H2O
2H+ + CaO > Ca2+ + H2O
2) 2HNO3 + Ba(OH)2 > Ba(NO3)2 + 2H2O
2H+ + 2NO3- + Ba2+ + 2OH- > Ba2+ + 2NO3- + 2H2O
H+ + OH- > H2O
3) А) 2HNO3 + K2CO3 > 2KNO3 + H2O + CO2^
2H+ + 2NO3- + 2K+ + CO32- > 2K+ + 2NO3- + H2O + CO2^
2H+ + CO32- > H2O + CO2^
Б) 2HNO3 + K2SiO3 > H2SiO3v + 2KNO3
2H+ + 2NO3- + 2K+ + SiO32- > H2SiO3v + 2K+ + 2NO3-
2H+ + SiO32- > H2SiO3v
6. Окислительные свойства HNO3: взаимодействует с металлами до и после H2 в ряду напряжений металлов, образуя соль, воду и какой-либо продукт восстановления N(+5). Рассмотрите ОВР, схемы которых:
1) Cu0 + HN5+O3 (конц.) > Cu2+(NO3)2 + N4+O2^ + H2O
N5+ + e > N4+ 1 2 2 – окислитель, восстановление
Cu0 - 2e > Cu+2 2 1 – восстановитель, окисление
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2^ + 2H2O
2) Cu0 + HN5+O3 (разб.) > Cu2+(NO3)2 + N2+O^ + H2O
N5+ + 3e > N2+ 3 6 2 – окислитель, восстановление
Cu0 - 2e > Cu+2 2 3 – восстановитель, окисление
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO^ + 4H2O
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









