Часть II Параграф 31 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1

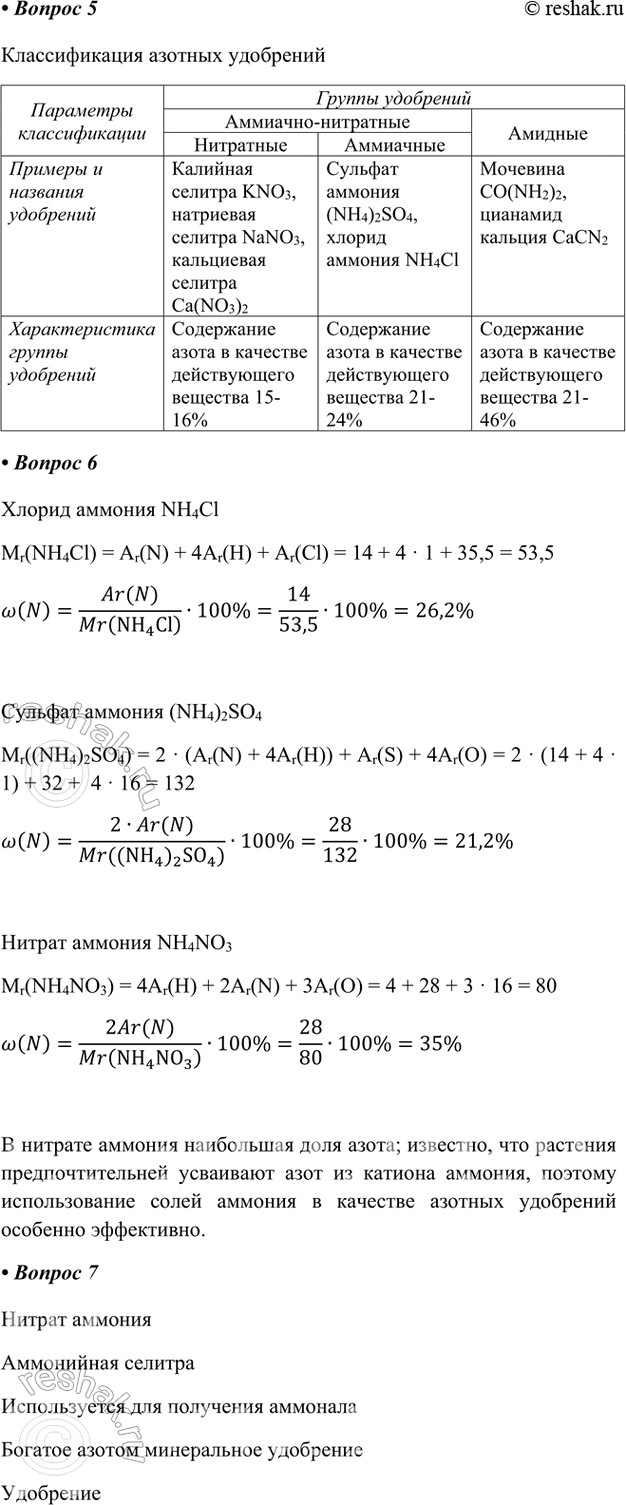

Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
Часть II
1. Как распознать растворы хлорида, сульфата и карбоната аммония? Предложите ход анализа и напишите уравнения соответствующих реакций в молекулярном и ионном видах.
В каждую пробирку добавляют соляную кислоту. В пробирке, содержащей раствор карбоната аммония, наблюдается выделение пузырьков газа:
(NH4)2CO3 + 2HCl > 2NH4Cl + H2O + CO2^
2NH4+ + CO32- + 2H+ + 2 Cl- > 2NH4+ + 2Cl- + H2O + CO2^
CO32- + 2H+ > H2O + CO2^
В оставшиеся пробирки добавляют нитрат бария. В пробирке, содержащей раствор сульфата аммония, наблюдается выпадение белого осадка:
(NH4)2SO4 + Ba(NO3)2 > 2NH4NO3 + BaSO4v
2NH4+ + SO42- + Ba2+ + 2NO3- > 2NH4+ + 2NO3- + BaSO4v
Ba2+ + SO42- > BaSO4v
В оставшейся пробирке – хлорид аммония. При добавлении нитрата серебра наблюдается выпадение белого осадка:
NH4Cl + AgNO3 > AgClv + NH4NO3
NH4+ + Cl- + Ag+ + NO3- > AgClv + NH4+ + NO3-
Ag+ + Cl- > AgClv
2. Составьте уравнения реакций для переходов:
NH3 > (NH4)2SO4 > NH4Cl > NH4NO3
1. 2NH3 + H2SO4 > (NH4)2SO4
2. (NH4)2SO4 + BaCl2 > 2NH4Cl + BaSO4v
3. NH4Cl + AgNO3 > AgClv + NH4NO3
3. Рассмотрите ОВР, схема которой
NaNO2 + NH4Cl > N2 + H2O + _
NaN+3O2 + N-3H4Cl > N02 + H2O + NaCl
2N+3 + 6e > N02 6 6 1 – окислитель, восстановление
2N-3 - 6e > N02 6 1 – восстановитель, окисление
NaNO2 + NH4Cl = N2 + 2H2O + NaCl
4. Рассмотрите ОВР, схема которой:
NH4NO3 > N2O + H2O
N-3H4N+5O3 > N+2O + H2O
N+5 + 4e > N+ 4 4 1 – окислитель, восстановление
N-3 - 4e > N+ 4 1 – восстановитель, окисление
NH4NO3 = N2O + 2H2O
5. Предложите классификацию азотных удобрений (используйте приложение к учебнику или найдите необходимую информацию с помощью Интернета). Дайте краткую характеристику каждой группы удобрений, заполнив таблицу «Классификация удобрений».
6. Сравните содержание азота в хлориде, сульфате и нитрате аммония. Какое из перечисленных соединений представляет большую ценность для минерального питания растений? Только ли по этой причине вы можете рекомендовать его к применению?
Хлорид аммония NH4Cl
Mr(NH4Cl) = Ar(N) + 4Ar(H) + Ar(Cl) = 14 + 4 · 1 + 35,5 = 53,5
Сульфат аммония (NH4)2SO4
Mr((NH4)2SO4) = 2 · (Ar(N) + 4Ar(H)) + Ar(S) + 4Ar(O) = 2 · (14 + 4 · 1) + 32 + 4 · 16 = 132
Нитрат аммония NH4NO3
Mr(NH4NO3) = 4Ar(H) + 2Ar(N) + 3Ar(O) = 4 + 28 + 3 · 16 = 80
В нитрате аммония наибольшая доля азота; известно, что растения предпочтительней усваивают азот из катиона аммония, поэтому использование солей аммония в качестве азотных удобрений особенно эффективно.
7. Напишите синквейн об одной из солей аммония.
Нитрат аммония
Аммонийная селитра
Используется для получения аммонала
Богатое азотом минеральное удобрение
Удобрение
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









