Часть II Параграф 24 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1



Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
Часть II
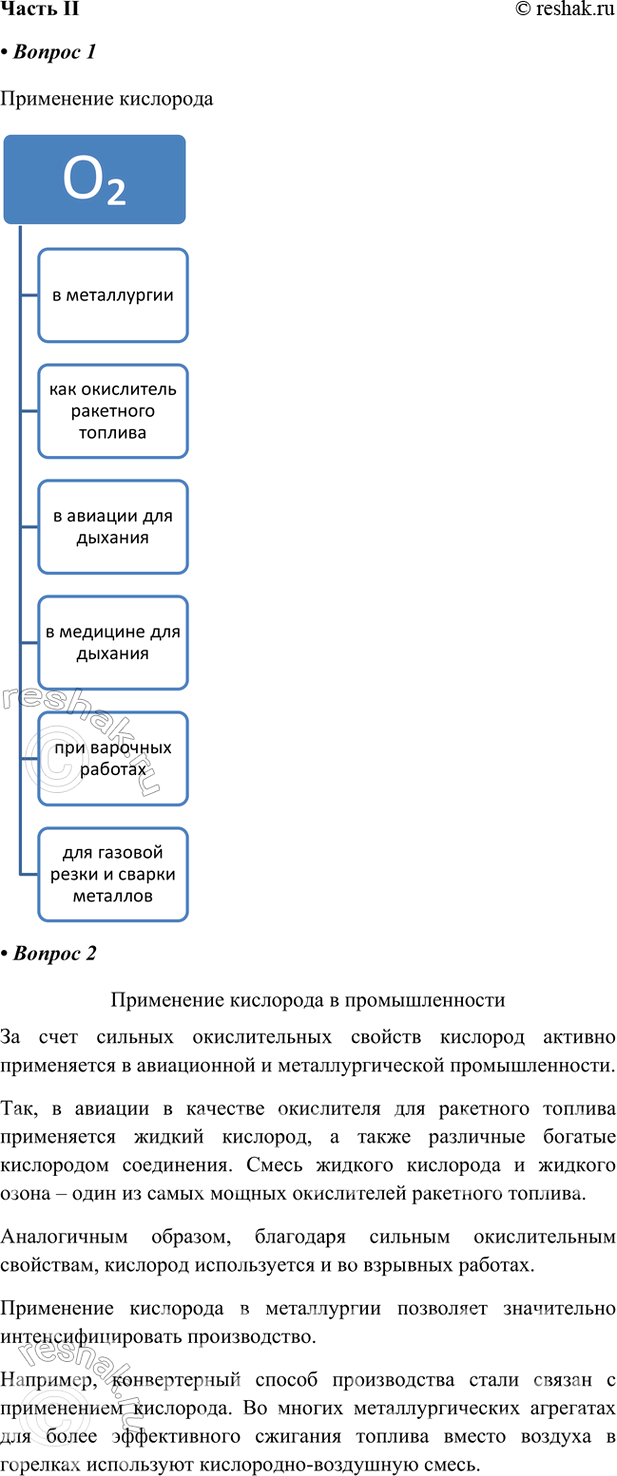
1. Заполните схему «Применение кислорода».
2. С помощью Интернета подготовьте небольшое сообщение по теме «Интенсификация металлургических и других промышленных процессов с помощью кислорода». Запишите план или тезисы сообщения в особой тетради.
Применение кислорода в промышленности
За счет сильных окислительных свойств кислород активно применяется в авиационной и металлургической промышленности.
Так, в авиации в качестве окислителя для ракетного топлива применяется жидкий кислород, а также различные богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона – один из самых мощных окислителей ракетного топлива.
Аналогичным образом, благодаря сильным окислительным свойствам, кислород используется и во взрывных работах.
Применение кислорода в металлургии позволяет значительно интенсифицировать производство.
Например, конвертерный способ производства стали связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
3. Запишите схемы реакций, протекание которых возможно. Рассмотрите уравнения реакций с позиций окисления-восстановления.
А) Cl2 + O2 > реакция не идет
Б) Pt + O2 > реакция не идет
В) C0 + O02 > C+4O-22
O02 + 4e > 2O-2 4 4 1 – окислитель, восстановление
C0 - 4e > C+4 4 1 – восстановитель, окисление
C + O2 = CO2
Г) C+2O + O02 > C+4O-22
O02 + 4e > 2O-2 4 4 1 – окислитель, восстановление
C+2 - 2e > C+4 2 2 – восстановитель, окисление
2CO + O2 = 2CO2
Д) Cu0 + O02 > Cu+2O-2
O02 + 4e > 2O-2 4 4 1 – окислитель, восстановление
Cu0 - 2e > Cu+2 2 2 – восстановитель, окисление
2Cu + O2 = 2CuO
Напрямую (при обычных условиях) с кислородом не взаимодействуют: хлор, бром, золото, платина и благородные газы.
4. В лаборатории собирают кислород в сосуд с помощью вытеснения ВОДЫ или ВОЗДУХА. Распознают с помощью тлеющей лучинки, которая загорается в атмосфере кислорода.
5. Сравните свойства и области применения кислорода и озона.
ПРИЗНАКИ — O2 — O3
Сходства
Газ
Сильный окислитель
Химически активен
Различия
Без цвета
Без запаха
Устойчивая молекула
Не проявляет сильных бактерицидных свойств
Поддерживает дыхание
Газ синеватого цвета
Газ с характерным запахом
Термически неустойчив
Проявляет сильные бактерицидные свойства
Не поддерживает дыхание
6. Дополните цепочку переходов. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:
H2O2 > X1 > SO2 > X2 > H2SO4
1) 2H2O2 > O2 + 2H2O
2) S + O2 > SO2
3) 2SO2 + O2 > 2SO3
4) SO3 + H2O > H2SO4
7. Придумайте и запишите условия задачи на нахождение объёма воздуха, необходимого для сжигания известного объёма углеводорода (этана; уточните формулу). Решите задачу, используя правило Гей-Люссака.
Какой объем воздуха необходим для полного сгорания 5 л этана?
Решите задачу, используя правило ГЕЙ-ЛЮССАКА.
Дано:
V(C2H6)=5 л
w(O2)=21%
V(воздуха)=?
2C2H6 + 7O2 > 4CO2 + 6H2O
Ответ. 83,3 л.
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









