Часть II Параграф 14 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1

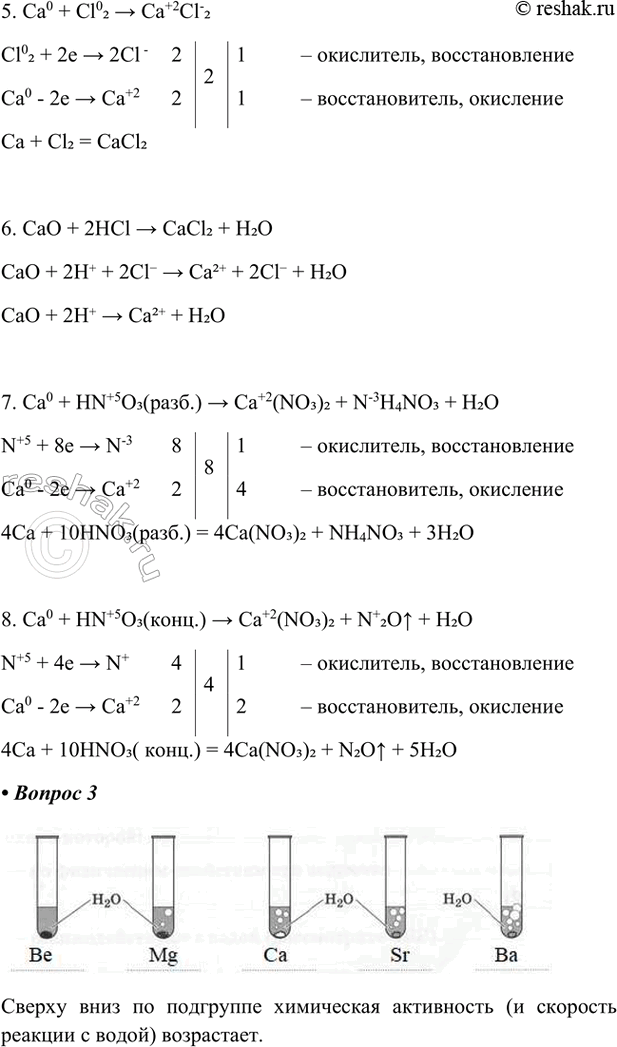



Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
Часть II
1. Заполните таблицу «Применение кальция и магния».
МЕТАЛЛ — ПРИМЕНЕНИЕ
Металл
Mg
Ca
Применение
Металлургия (магниетермия), огнеупорные материалы, зажигательные смеси
Металлургия (кальциетермия), производство сталей
2. Дополните цепочку переходов. Составьте уравнения реакций, с помощью которых можно осуществить превращения по схеме:
Ca > X1 > X2 > CaCl2 > Ca(NO3)2
Первую и пятую реакции рассмотрите с позиций окисления-восстановления, остальные — в свете ТЭД. Для перехода Ca > Ca(NO3)2 предложите два варианта.
1. Ca0 + O02 > Ca+2O-2
O02 + 4e > 2O-2 4 4 1 – окислитель, восстановление
Ca0 - 2e > Ca+2 2 2 – восстановитель, окисление
2Ca + O2 = 2CaO
2. CaO + H2O > Ca(OH)2
3. Ca(OH)2 + 2HCl > CaCl2 + 2H2O
Ca2+ + 2OH- + 2H+ + 2Cl- > Ca2+ + 2Cl- + 2H2O
OH- + H+ > H2O
4. CaCl2 + 2AgNO3 > 2AgClv + Ca(NO3)2
Ca2+ + 2Cl- + 2Ag+ + 2NO3- > 2AgClv + Ca2+ + 2NO3-
Ag+ + Cl- > AgClv
5. Ca0 + Cl02 > Ca+2Cl-2
Cl02 + 2e > 2Cl - 2 2 1 – окислитель, восстановление
Ca0 - 2e > Ca+2 2 1 – восстановитель, окисление
Ca + Cl2 = CaCl2
6. CaO + 2HCl > CaCl2 + H2O
CaO + 2H+ + 2Cl- > Ca2+ + 2Cl- + H2O
CaO + 2H+ > Ca2+ + H2O
7. Ca0 + HN+5O3(разб.) > Ca+2(NO3)2 + N-3H4NO3 + H2O
N+5 + 8e > N-3 8 8 1 – окислитель, восстановление
Ca0 - 2e > Ca+2 2 4 – восстановитель, окисление
4Ca + 10HNO3(разб.) = 4Ca(NO3)2 + NH4NO3 + 3H2O
8. Ca0 + HN+5O3(конц.) > Ca+2(NO3)2 + N+2O^ + H2O
N+5 + 4e > N+ 4 4 1 – окислитель, восстановление
Ca0 - 2e > Ca+2 2 2 – восстановитель, окисление
4Ca + 10HNO3( конц.) = 4Ca(NO3)2 + N2O^ + 5H2O
3. Проанализируйте рисунок «Взаимодействие щёлочноземельных металлов с водой». Подпишите химические формулы металлов. Объясните причину различной скорости реакций.
Сверху вниз по подгруппе химическая активность (и скорость реакции с водой) возрастает.
4. Укажите, в какой из пробирок отображено взаимодействие __________________. Ответ поясните: __________________.
Щелочные металлы растворяются в воде со взрывом:
2Li + 2H2O > 2LiOH + H2^
Кальций взаимодействует с водой с образованием малорастворимого гидроксида:
Ca + 2H2O > Ca(OH)2v + H2^
5. Какой объём водорода образуется при взаимодействии с 0,5 л воды 20 г кальция, содержащего 5% примесей? Рассчитайте массовую долю щёлочи в полученном растворе.
Дано:
m(Ca технич.)=20 г
w(прим.)=5%
M(Ca)= 40 г/моль
M(Ca(OH)2)= 74 г/моль
M(H2)= 2 г/моль
Vm= 22,4 л/моль
V(H2O)=0,5 л
V(H2)=?
w(Ca(OH)2)=?
Ca + 2H2O > Ca(OH)2v + H2^
w(Ca)=100% - w(прим.)= 100% - 5% = 95%
m(Ca)= m(Ca технич.) · w(Ca)/100%= = 20·0,95= 19 (г)
n(Ca)=m/M=19 /40= 0,475 (моль)
V(H2)=n· Vm=0,475 ·22,4=10,64 (л)
m(H2)= n· M=0,475 · 2= 0,95 (г)
m(Ca(OH)2)= n· M=0,475 · 74= 35,15 (г)
0,5 л H2O = 500 г
m(раствора)= m(Ca технич.) + m(H2O) - m(H2) = 20 + 500 – 0,95 = 519,05 (г)
w(Ca(OH)2)= m(Ca(OH)2) / m(раствора)= 35,15 / 519,05 = 0,068 = 6,8%
Ответ. 10,64 л, 6,8%.
6. Придумайте и решите задачу, аналогичную предыдущей, чтобы в условии фигурировал гидрид кальция.
Какой объем водорода образуется при взаимодействии с 0,5 л воды 20 г гидрида кальция, содержащего 5% примесей? Рассчитайте массовую долю щелочи в полученном растворе.
Дано:
m(CaH2 технич.)=20 г
w(прим.)=5%
M(CaH2)= 42 г/моль
M(Ca(OH)2)= 74 г/моль
M(H2)= 2 г/моль
Vm= 22,4 л/моль
V(H2O)=0,5 л
V(H2)=?
w(Ca(OH)2)=?
CaH2 + 2H2O > Ca(OH)2v + 2H2^
w(CaH2)=100% - w(прим.)= 100% - 5% = 95%
m(CaH2)= m(CaH2технич.) · w(CaH2)/100%= = 20·0,95= 19 (г)
n(CaH2)=m/M=19 /42= 0,452 (моль)
V(H2)=n· Vm=0,904 ·22,4=20,25 (л)
m(H2)= n· M=0,904 · 2= 1,808 (г)
m(Ca(OH)2)= n· M=0,452 · 74= 33,448 (г)
0,5 л H2O = 500 г
m(раствора)= m(CaH2 технич.) + m(H2O) - m(H2) = 20 + 500 – 1,808= 518,192 (г)
w(Ca(OH)2)= m(Ca(OH)2) / m(раствора)= 33,448 / 518,192 = 0,065 = 6,5%
Ответ. 20,25 л, 6,5%.
7. Подготовьте небольшое сообщение об одном из щёлочноземельных металлов, используя Интернет и другие источники информации (укажите). Составьте план или запишите тезисы сообщения в особой тетради.
Источник: Большая Российская Энциклопедия (https://bigenc.ru/c/kal-tsii-8db357)
Кальций (лат. Calcium), Ca, химический элемент IIA группы Периодической системы; относится к щелочноземельным металлам; атомный номер 20; атомная масса 40,078 а. е. м.
Многие природные соединения кальция были известны в глубокой древности и широко применялись в строительстве (например, гипс, известь, мрамор). Металлический кальций впервые выделен Г. Дэви в 1808 г. при электролизе смеси оксидов CaO и HgO и последующем разложении образовавшейся амальгамы кальция. Название происходит от латинского calx (род. падеж calcis) – известь, мягкий камень.
Кальций – металл высокой химической активности (хранят в герметически закрытых сосудах или под слоем минерального масла). При нормальных условиях легко взаимодействует с кислородом (образуется кальция оксид CaO), при нагревании – с водородом (гидрид CaH2), углеродом (карбид кальция CaC2), азотом (нитрид Ca3N2), , халькогенами (халькогениды состава CaX, где X – S, Se, Te). Интенсивно реагирует с галогенами с образованием галогенидов. Металлический кальций взаимодействует с водой с образованием гидроксида кальция Ca(OH)2 и H2. Энергично взаимодействует с большинством кислот, образуя соответствующие соли (например, нитрат кальция, сульфат кальция, фосфаты кальция).
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









