Часть II Параграф 13 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1

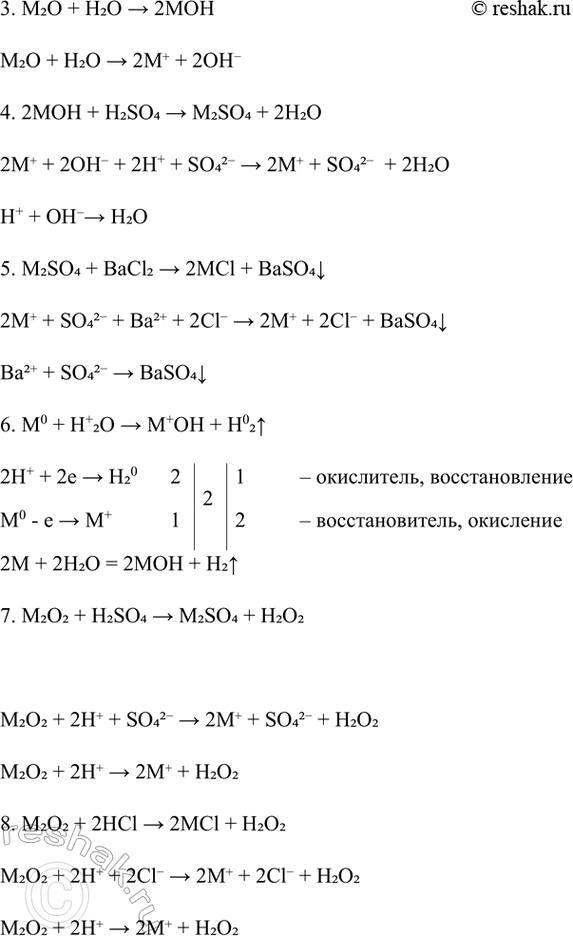



Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
Часть II
1. Заполните таблицу «Биологическая роль катионов натрия и калия».
КАТИОН — БИОЛОГИЧЕСКАЯ РОЛЬ — ПРОДУКТЫ, БОГАТЫЕ КАТИОНАМИ
2. Дополните цепочку переходов. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме. Там, где необходимо, рассмотрите переходы как ОВР и представьте в свете ТЭД.
1. M0 + O02 > M+2O-2
O02 + 2e > 2O- 2 2 1 – окислитель, восстановление
M0 - e > M+ 1 2 – восстановитель, окисление
2M + O2 = M2O2
2. M+2O-2 + M0 > M+2O-2
O- + e > O-2 1 1 1 – окислитель, восстановление
M0 - e > M+ 1 1 – восстановитель, окисление
M2O2 + 2M > 2M2O
3. M2O + H2O > 2MOH
M2O + H2O > 2M+ + 2OH-
4. 2MOH + H2SO4 > M2SO4 + 2H2O
2M+ + 2OH- + 2H+ + SO42- > 2M+ + SO42- + 2H2O
H+ + OH- > H2O
5. M2SO4 + BaCl2 > 2MCl + BaSO4v
2M+ + SO42- + Ba2+ + 2Cl- > 2M+ + 2Cl- + BaSO4v
Ba2+ + SO42- > BaSO4v
6. M0 + H+2O > M+OH + H02^
2H+ + 2e > H20 2 2 1 – окислитель, восстановление
M0 - e > M+ 1 2 – восстановитель, окисление
2M + 2H2O = 2MOH + H2^
7. M2O2 + H2SO4 > M2SO4 + H2O2
M2O2 + 2H+ + SO42- > 2M+ + SO42- + H2O2
M2O2 + 2H+ > 2M+ + H2O2
8. M2O2 + 2HCl > 2MCl + H2O2
M2O2 + 2H+ + 2Cl- > 2M+ + 2Cl- + H2O2
M2O2 + 2H+ > 2M+ + H2O2
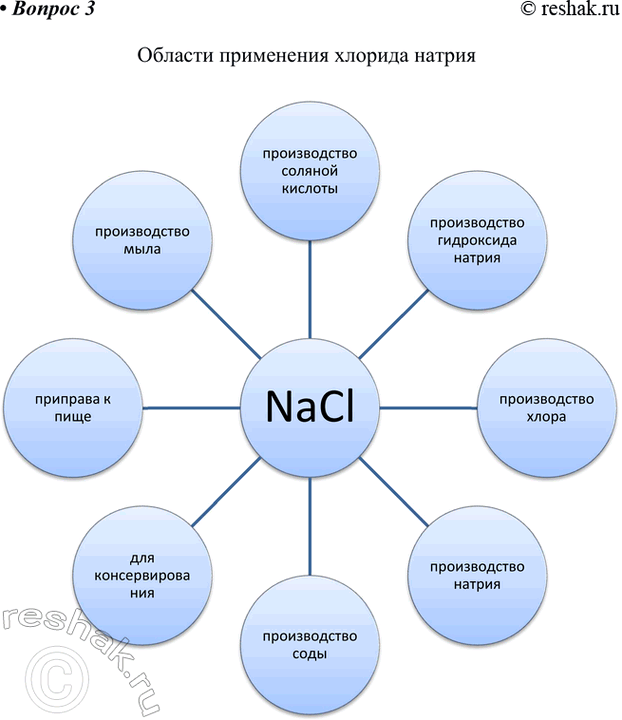
3. Заполните схему «Области применения хлорида натрия».
4. Для соединения NaH укажите:
1) название: гидрид натрия
2) тип связи и кристаллическая решетка: ионная
3) схема образования связи на основе реакции получения (синтеза):
Na0 – e > Na+
H20 +2e > 2H-
Na+ + H- > NaH
4) уравнение реакции взаимодействия с водой:
NaH- + H+2O > NaOH + H20^
2H++ 2e > H20 2 2 1 – окислитель, восстановление
2H- - 2e > H20 2 1 – восстановитель, окисление
NaH + H2O = NaOH + H2^
5. Пероксид натрия Na2O2 имеет структурную формулу: Na—O—O—Na.
Тип связи между атомами:
а) натрия и кислорода – ионная
б) кислорода и кислорода – ковалентная поляная
Наличие разных типов связи в одном соединении говорит о условности классифиакции и единстве природы химической связи.
6. По образцу сочинения, приведённого в заданиях учебного параграфа, напишите сочинение на тему «Художественный образ соединения щелочного металла» в особой тетради.
Сочинение
Щелочные металлы всегда отличались неуемным характером и повышенной инициативностью. Они вели очень активный образ жизни. Правда была и обратная сторона – им всегда сложно было проявлять чувство меры, вовремя остановиться и подумать. По этой причине, некоторые реакции у них шли не как у всех. Например, в реакциях с кислородом они были настолько активны, что парочка щелочных металлов могла заарканить не одного, а целых два кислорода:
Правда, у лития этот трюк обычно не получался:
Но веселее всего было, когда набиралась довольно большая группа щелочных металлов, и они шли купаться.
Чаще всего подобные развлечения оканчивались взрывами:
2Na+2H2O = 2NaOH+H2^+Q
Когда взрывов становилось уж очень много, к щелочным металлам применялись санкции: их клали под керосин. Правда литию удалось–таки вырваться из-под керосина, но мера пресечения за это была довольно жесткой: всех щелочные металлы клали под керосин, а литий – под вазелин.
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









