Часть II Параграф 15 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1
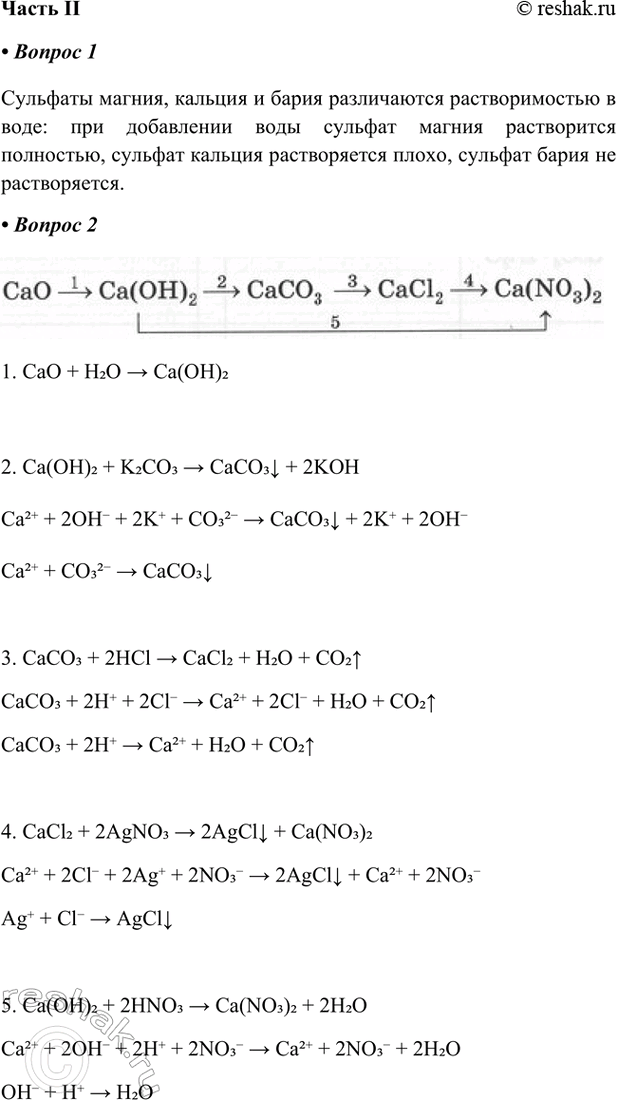


Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
Часть II
1. Как различить кристаллические сульфаты магния, кальция, бария?
Сульфаты магния, кальция и бария различаются растворимостью в воде: при добавлении воды сульфат магния растворится полностью, сульфат кальция растворяется плохо, сульфат бария не растворяется.
2. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
CaO > Ca(OH)2 > CaCO3 > CaCl2 > Ca(NO3)2
Для всех реакций, кроме первой, запишите уравнения в молекулярной, полной и сокращённой ионной формах.
1. CaO + H2O > Ca(OH)2
2. Ca(OH)2 + K2CO3 > CaCO3v + 2KOH
Ca2+ + 2OH- + 2K+ + CO32- > CaCO3v + 2K+ + 2OH-
Ca2+ + CO32- > CaCO3v
3. CaCO3 + 2HCl > CaCl2 + H2O + CO2^
CaCO3 + 2H+ + 2Cl- > Ca2+ + 2Cl- + H2O + CO2^
CaCO3 + 2H+ > Ca2+ + H2O + CO2^
4. CaCl2 + 2AgNO3 > 2AgClv + Ca(NO3)2
Ca2+ + 2Cl- + 2Ag+ + 2NO3- > 2AgClv + Ca2+ + 2NO3-
Ag+ + Cl- > AgClv
5. Ca(OH)2 + 2HNO3 > Ca(NO3)2 + 2H2O
Ca2+ + 2OH- + 2H+ + 2NO3- > Ca2+ + 2NO3- + 2H2O
OH- + H+ > H2O
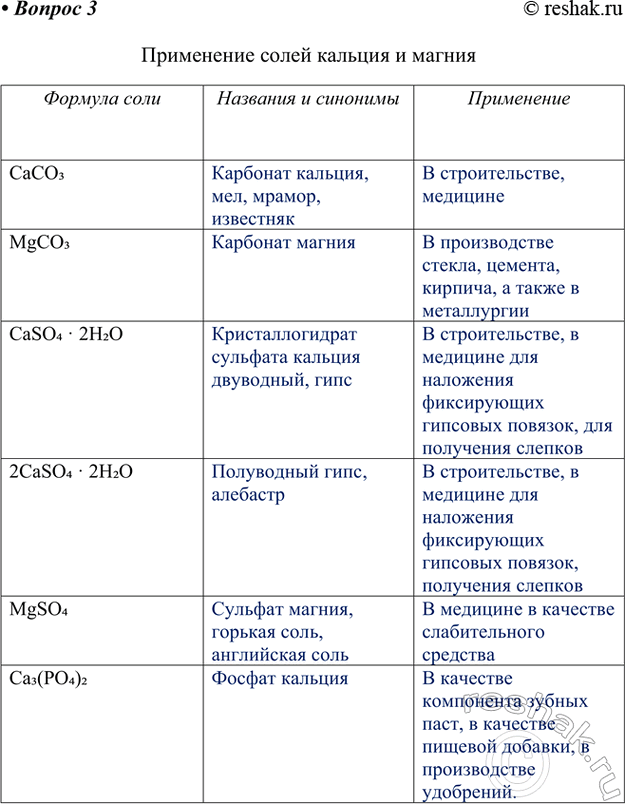
3. Заполните таблицу «Применение солей кальция и магния».
Формула соли
CaCO3
MgCO3
CaSO4 · 2H2O
2CaSO4 · 2H2O
MgSO4
Ca3(PO4)2
Названия и синонимы
Карбонат кальция, мел, мрамор, известняк
Карбонат магния
Кристаллогидрат сульфата кальция двуводный, гипс
Полуводный гипс, алебастр
Сульфат магния, горькая соль, английская соль
Фосфат кальция
Применение
В строительстве, медицине
В производстве стекла, цемента, кирпича, а также в металлургии
В строительстве, в медицине для наложения фиксирующих гипсовых повязок, для получения слепков
В строительстве, в медицине для наложения фиксирующих гипсовых повязок, получения слепков
В медицине в качестве слабительного средства
В качестве компонента зубных паст, в качестве пищевой добавки, в производстве удобрений.
4. Фосфоры – это специальные светящиеся краски на основе неорганических люминофоров.
Область их применения: для изготовления светящихся дорожных знаков, циферблатов часов и других изделий.
5. Напишите синквейн о химическом элементе кальции или его соединении.
Кальций
Типичный металл
Строительство, медицина, удобрения
Химически активный, сильный восстановитель
Щелочноземельный
6. Какую массу известняка, содержащего 20% примесей, подвергли обжигу, если получено 112 кг негашёной извести?
Дано:
w(прим.)=20%
m(CaO)=112 кг = = 112000 г
M(CaO)= 56 г/моль
M(CaCO3)= 100 г/моль
m(известняка)=?
CaCO3 > CaO + CO2
n(CaO)=m/M=112000/56 = 2000 (моль)
m(CaCO3)= n· M=2000· 100=200000 (г) = 200 (кг)
w(CaCO3)=100% - w(прим.)= 100% - 20% = 80%
Ответ. 250 кг.
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









