Часть II Параграф 12 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1
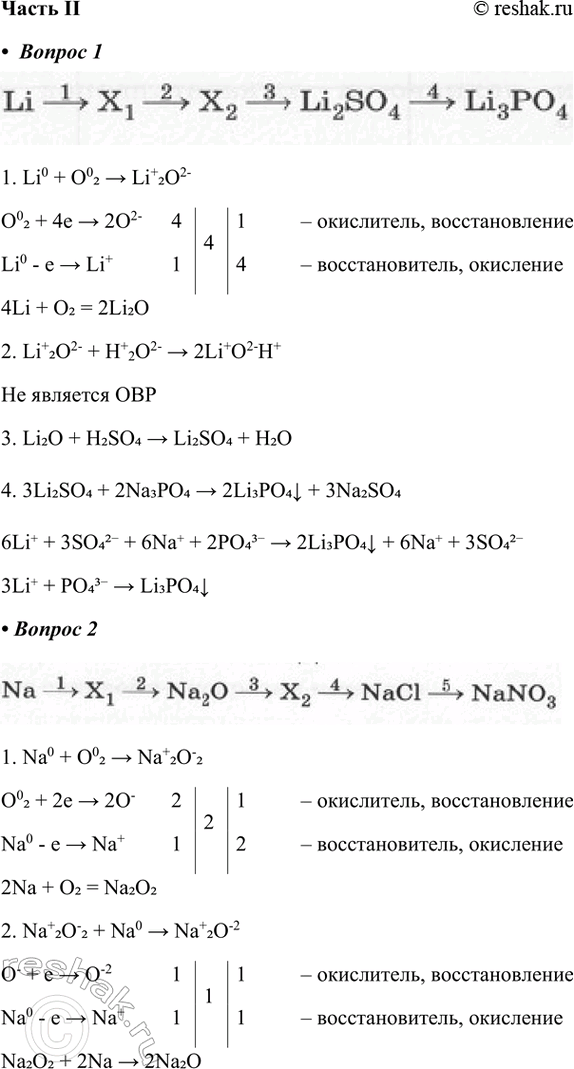




Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
Часть II
1. Дополните цепочку переходов. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме. Рассмотрите их с позиций окисления-восстановления, а последний переход представьте в свете ТЭД.
Li > X1 > X2 > Li2SO4 > Li3PO4
1. Li0 + O02 > Li+2O2-
O02 + 4e > 2O2- 4 4 1 – окислитель, восстановление
Li0 - e > Li+ 1 4 – восстановитель, окисление
4Li + O2 = 2Li2O
2. Li+2O2- + H+2O2- > 2Li+O2-H+
Не является ОВР
3. Li2O + H2SO4 > Li2SO4 + H2O
4. 3Li2SO4 + 2Na3PO4 > 2Li3PO4v + 3Na2SO4
6Li+ + 3SO42- + 6Na+ + 2PO43- > 2Li3PO4v + 6Na+ + 3SO42-
3Li+ + PO43- > Li3PO4v
2. Дополните цепочку переходов. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме. Рассмотрите переходы как ОВР, а два последних перехода представьте в свете ТЭД.
Na > X1 > Na2O > X2 > NaCl > NaNO3
1. Na0 + O02 > Na+2O-2
O02 + 2e > 2O- 2 2 1 – окислитель, восстановление
Na0 - e > Na+ 1 2 – восстановитель, окисление
2Na + O2 = Na2O2
2. Na+2O-2 + Na0 > Na+2O-2
O- + e > O-2 1 1 1 – окислитель, восстановление
Na0 - e > Na+ 1 1 – восстановитель, окисление
Na2O2 + 2Na > 2Na2O
3. Na2O + H2O > 2NaOH
4. NaOH + HCl > NaCl + H2O
Na+ + OH- + H+ + Cl- > Na+ + Cl- + H2O
H+ + OH- > H2O
5. NaCl + AgNO3 > AgClv + NaNO3
Na+ + Cl- + Ag+ + NO3- > AgClv + Na+ + NO3-
Ag+ + Cl- > AgClv
3. Сравните способы защиты от коррозии Li и Na.
ХАРАКТЕРИСТИКИ ЗАЩИТЫ ОТ КОРРОЗИИ — МЕТАЛЛЫ
4. Рассчитайте массу натрия и объём хлора, полученных в результате электролиза 585 кг хлорида натрия, содержащего 12% примесей.
Дано:
m(NaCl технич.)=585 кг = 585000 г
w(прим.)=12%
M(NaCl)= 58,5г/моль
M(Na)= 23 г/моль
Vm= 22,4 л/моль
V(Cl2)=?
m(Na)=?
2NaCl > 2Na + Cl2^
w(NaCl)=100% - w(прим.)= 100% - 12% = 88%
m(NaCl)= m(NaCl технич.) · w(NaCl)/100%= 585000·0,88= 514800 (г)
n(NaCl)=m/M=514800 /58,5=8800 (моль)
m(Na)= n· M=8800 · 23= 202400 (г) = 202,4 (кг)
V(Cl2)=n· Vm=4400 ·22,4=98560 (л) = 98,56 (м3)
Ответ. 202,4 кг, 98,56 м3.
5. Какой объём займёт водород, выделившийся при растворении в 0,5 л воды 69 г натрия? Какова массовая доля щёлочи в полученном растворе?
Дано:
m(Na)=69 г
V(H2O)=0,5 л
M(Na)= 23 г/моль
Vm= 22,4 л/моль
M(H2)= 2 г/моль
M(NaOH)= 40 г/моль
V(H2)=?
w(NaOH)= ?
2Na + 2H2O > 2NaOH + H2^
n(Na)=m/M=69/23=3 (моль)
V(H2)=n· Vm=1,5 ·22,4= 33,6 (л)
0,5 л H2O = 500 г H2O
m(H2)= n· M=1,5· 2=3 (г)
m(раствора)= m(Na) + m(H2O) - m(H2) =
69 + 500 – 3 = 566 (г)
m(NaOH)= n· M= 3· 40=120 (г)
w(NaOH)= m(NaOH) / m(раствора)= 120 / 566 = 0,212 = 21,2%
Ответ. 33,6 л, 21,2%.
6. С помощью дополнительных источников информации (укажите, в том числе Интернет) подготовьте небольшое сообщение об одном из щелочных металлов. Запишите план этого сообщения или тезисы в особой тетради.
Источник: Большая Российская Энциклопедия (https://bigenc.ru/c/natrii-314d69)
Натрий (лат. Natrium), Na, химический элемент IA группы Периодической системы; атомный номер 11; атомная масса 22,98976928; относится к щелочным металлам.
Природные соединения натрия известны с древних времен. В эпоху неолита, приблизительно 5–7 тыс. лет назад, в качестве компонента пищи людей вошла в употребление поваренная соль (хлорид натрия) NaCl. В Древнем Египте применяли природную соду (карбонат натрия) Na2CO3 как моющее средство, а также для варки стекла. К началу 18 в. в Западной Европе соли натрия широко применялись в медицине, при выделке кож, крашении тканей. В 1807 г. Г. Дэви электролизом расплава едкого натра NaOH впервые получил расплавленный металлический натрий и дал ему название «содиум» (sodium, от позднелат. soda – сода), которое отражает происхождение этого элемента из соды; название сохранилось в США, Великобритании и некоторых других странах. Название «натрий», происходящее от арабского «натрун» и первоначально относившееся к природной соде, предложено Й. Берцелиусом в 1811 г. и введено в отечественную химическую номенклатуру Г. И. Гессом в 1831 г.
Натрий – металл высокой химической активности (хранят под слоем инертной обезвоженной и не содержащей кислорода жидкости – керосина, минерального масла; перевозят в запаянных металлических сосудах). В реакциях с различными соединениями (оксидами, галогенидами и пр.) ведет себя как сильный восстановитель. На воздухе активно окисляется с поверхности, в жидком состоянии при температуре выше 200 °С загорается. В зависимости от условий может окисляться до оксида Na2O или пероксида Na2O2. Энергично реагирует с водой с образованием гидроксида NaOH и H2, за счет выделяющейся энергии Na плавится; при большой поверхности контакта реакция происходит со взрывом. Натрий воспламеняется в атмосфере фтора, в атмосфере хлора горит при комнатной температуре, с бромом реагирует лишь при нагревании.
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









