Часть I Параграф 22 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1



Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
ГАЛОГЕНЫ
Часть I
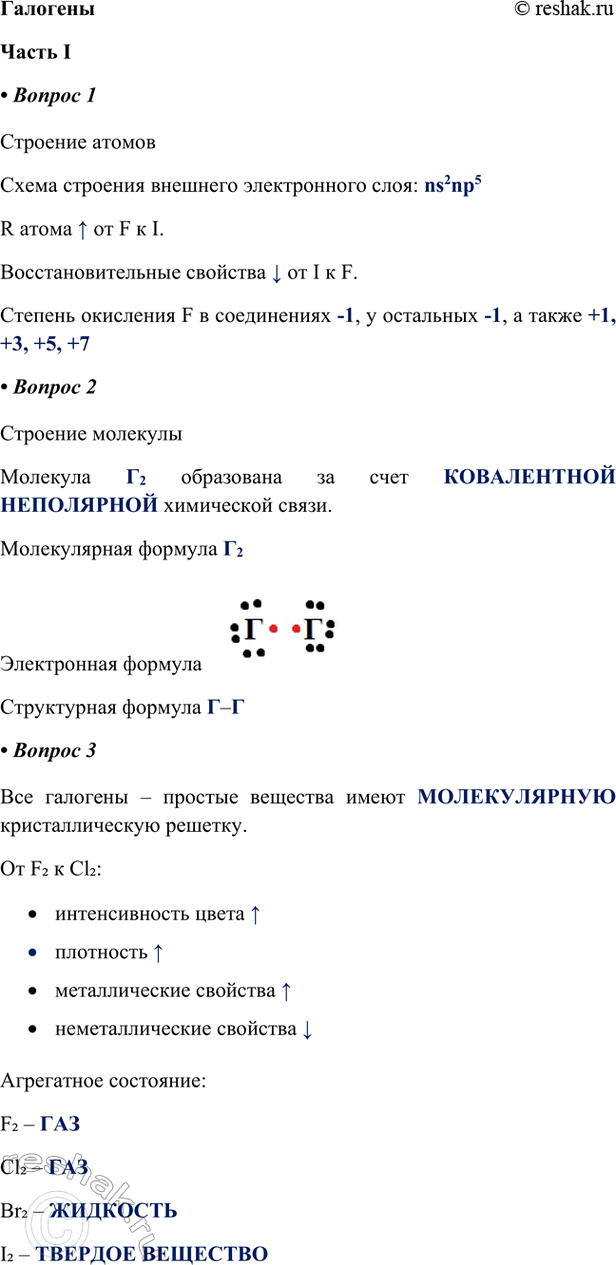
1. Строение атомов
Схема строения внешнего электронного слоя: ns2np5
R атома ^ от F к I.
Восстановительные свойства v от I к F.
Степень окисления F в соединениях -1, у остальных -1, а также +1, +3, +5, +7
2. Строение молекулы
Молекула Г2 образована за счет КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ химической связи.
Молекулярная формула Г2
Электронная формула
Структурная формула Г–Г
3. Все галогены – простые вещества имеют МОЛЕКУЛЯРНУЮ кристаллическую решетку.
От F2 к Cl2:
• интенсивность цвета ^
• плотность ^
• металлические свойства ^
• неметаллические свойства v
Агрегатное состояние:
F2 – ГАЗ
Cl2 – ГАЗ
Br2 – ЖИДКОСТЬ
I2 – ТВЕРДОЕ ВЕЩЕСТВО
4. Химические свойства.
Наиболее характерны ОКИСЛИТЕЛЬНЫЕ свойства, которые галогены проявляют по отношению к:
1) к металлам:
А) Г02 + Na0 > Na+Г-
Г02+ 2e > 2Г- 2 2 1 – окислитель, восстановление
Na0 - e > Na+ 1 2 – восстановитель, окисление
Г2 + 2Na = 2NaГ
Б) Г02 + Ca0 > Ca+2Г2-
Г02+ 2e > 2Г- 2 2 1 – окислитель, восстановление
Ca0 - 2e > Ca+2 2 1 – восстановитель, окисление
Г2 + Ca = 2CaГ2
В) Fe0 + Г02 > Fe+3Г-3
Г02 + 2e > 2Г- 2 6 3 – окислитель, восстановление
Fe0 - 3e > Fe+3 3 2 – восстановитель, окисление
2Fe + 3Г2 = 2FeГ3
2) к водороду:
Потому что: от фтора к иоду окислительные свойства галогенов ослабевают.
3) К растворам солей, содержащим менее активные галогены:
F2 > Cl2 > Br2 > I2 – ряд активности галогенов
Cl02 + KBr- > KCl- + Br02
Cl02 + 2e > 2Cl- 2 2 1 – окислитель, восстановление
2Br- - 2e > Br02 2 1 – восстановитель, окисление
Cl2 + 2KBr = 2KCl + Br2
Br02 + NaI- > NaBr- + I02
Br02 + 2e > 2Br- 2 2 1 – окислитель, восстановление
2I- - 2e > I02 2 1 – восстановитель, окисление
Br2 + 2NaI = 2NaBr + I2
F02 + H2O-2 > HF- + O02
F02 + 2e > 2F- 2 4 2 – окислитель, восстановление
2O-2 - 4e > O02 4 1 – восстановитель, окисление
2F2 + 2H2O = 4HF + O2
4) К менее электроотрицательным HM:
P0 + Cl02 > P+5Cl-5
Cl02 + 2e > 2Cl- 2 10 5 – окислитель, восстановление
P0 - 5e > P+5 5 2 – восстановитель, окисление
2P + 5Cl2 = 2PCl5
5. Соединения в природе
В свободном виде не встречаются из-за высокой химической активности.
Это галогениды металлов IA и IIA групп (приведите примеры: запишите формулы основных соединений минералов, дайте их названия и синонимы).
• флюорит (плавиковый шпат) CaF2
• галит (каменная соль) NaCl
• сильвин KCl
• карналлит KCl · MgCl2 · 6H2O
6. Получение галогенов электролизом:
1) Растворов галогенидов, уравнение процесса:
2KCl + 2H2O > электролиз 2KOH + H2 + Cl2^
2) Расплавов галогенидов, уравнение процесса:
2NaCl > электролиз 2Na + Cl2^
7. Заполните схему «Применение хлора».
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.