Часть II Параграф 21 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1



Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
Часть II
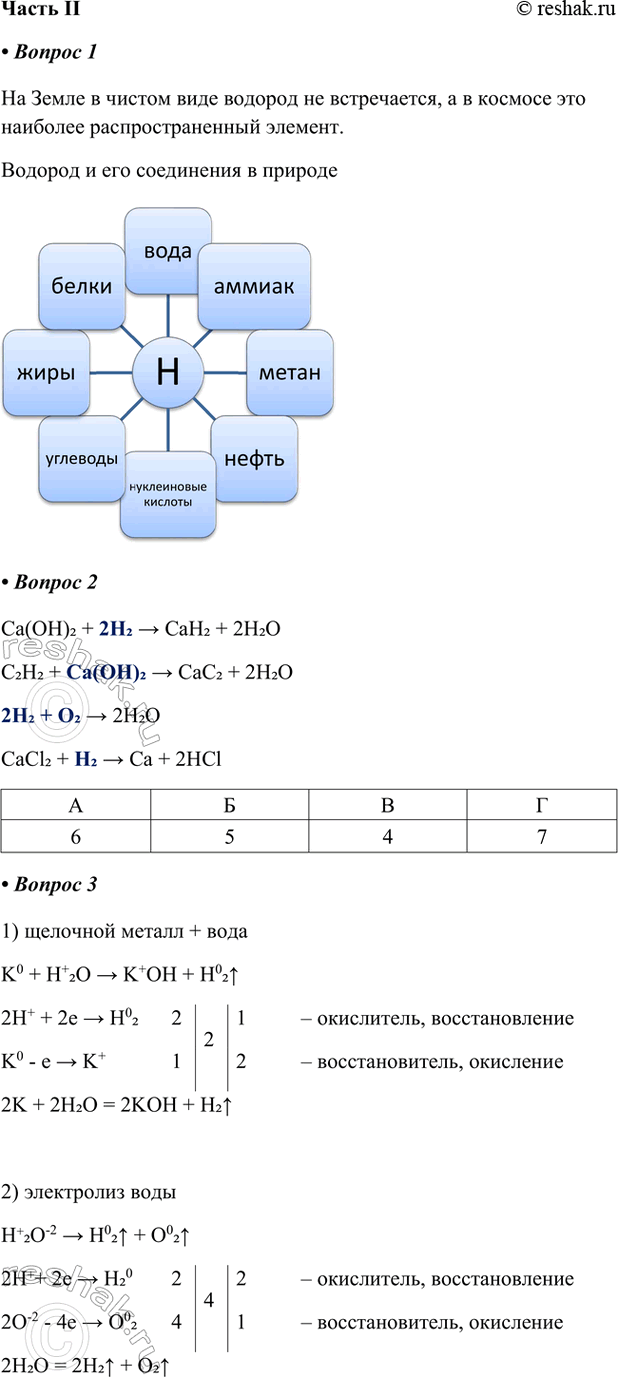
1. На Земле в чистом виде водород не встречается, а в космосе это наиболее распространенный элемент.
Заполните схему «Водород и его соединения в природе».
2. Установите соответствие между продуктами реакции и исходными веществами.
ПРОДУКТЫ РЕАКЦИИ — ИСХОДНЫЕ ВЕЩЕСТВА
Ca(OH)2 + 2H2 > CaH2 + 2H2O
C2H2 + Ca(OH)2 > CaC2 + 2H2O
2H2 + O2 > 2H2O
CaCl2 + H2 > Ca + 2HCl
А Б В Г
6 5 4 7
3. Запишите уравнения реакций возможных способов получения водорода в лаборатории и рассмотрите с позиций окисления-восстановления.
1) щелочной металл + вода
K0 + H+2O > K+OH + H02^
2H+ + 2e > H02 2 2 1 – окислитель, восстановление
K0 - e > K+ 1 2 – восстановитель, окисление
2K + 2H2O = 2KOH + H2^
2) электролиз воды
H+2O-2 > H02^ + O02^
2H++ 2e > H20 2 4 2 – окислитель, восстановление
2O-2 - 4e > O02 4 1 – восстановитель, окисление
2H2O = 2H2^ + O2^
3) кислота + металл
Zn0 + H+Cl > Zn+2Cl2 + H02
2H+ + 2e > H02 2 2 1 – окислитель, восстановление
Zn0 - 2e > Zn+2 2 1 – восстановитель, окисление
Zn + 2HCl = ZnCl2 + H2
4) щелочноземельный металл + вода
Ca0 + H+2O > Ca+2(OH)2 + H02^
2H+ + 2e > H02 2 2 1 – окислитель, восстановление
Ca0 - 2e > Ca+2 2 1 – восстановитель, окисление
Ca + 2H2O = Ca(OH)2 + H2^
5) взаимодействие алюминия с щелочью
Al0 + KOH+ + H+2O > K[Al+3(OH)4] + H02^
2H+ + 2e > H02 2 6 3 – окислитель, восстановление
Al0 - 3e > Al+3 3 2 – восстановитель, окисление
2Al + 2KOH + 6H2O = 2K[Al(OH)4] + 3H2^
4. Закончите уравнение реакции и рассмотрите её с позиций окисления-восстановления:
Fe2O3 + H2 > __________________ + __________________
Fe2+3O3 + H02 > Fe0 + H+2O
Fe+3 + 3e > Fe0 3 6 2 – окислитель, восстановление
H02 - 2e > 2H+ 2 3 – восстановитель, окисление
Fe2O3 + 3H2 = 2Fe + 3H2O
К какому типу металлургии можно отнести данный процесс?
ПИРОМЕТАЛЛУРГИЯ
5. Какой объём воздуха нужен для сжигания 120 м3 водорода?
Дано:
V(H2)=120 м3
V(воздуха)=?
2H2 + O2 > 2H2O
x= V(O2)= 120·1/2=60 (м3)
Ответ. 285,7 м3.
6. На основании решения задания 5 сформулируйте правило Гей-Люссака: объёмы газообразных веществ, участвующих в реакции, соотносятся между собой как __________________.
Правило Гей-Люссака: объемы газообразных веществ, участвующих в реакции, соотносятся между собой как целые числа, равные стехиометрическим коэффициентам в уравнении реакции.
7. Вспомните и запишите определение. Изотопы – это разновидность атомов одного и того же химического элемента, которые имеют одинаковое число протонов в ядре (заряд ядра), но отличаются количеством нейтронов.
8. Укажите три вида изотопов водорода.
9. Используя Интернет и другие источники информации (укажите), подготовьте презентацию на тему «Применение тяжёлых изотопов водорода». Запишите план презентации в особой тетради.
См. презентацию
План презентации:
• Дейтерий и тритий
• Ядерная промышленность
• Тяжелая вода
• Изотопы-маркеры
• Применение в медицине
• Производство люминофоров
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.