Часть I Параграф 18 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1


Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
ЖЕЛЕЗО
Часть I
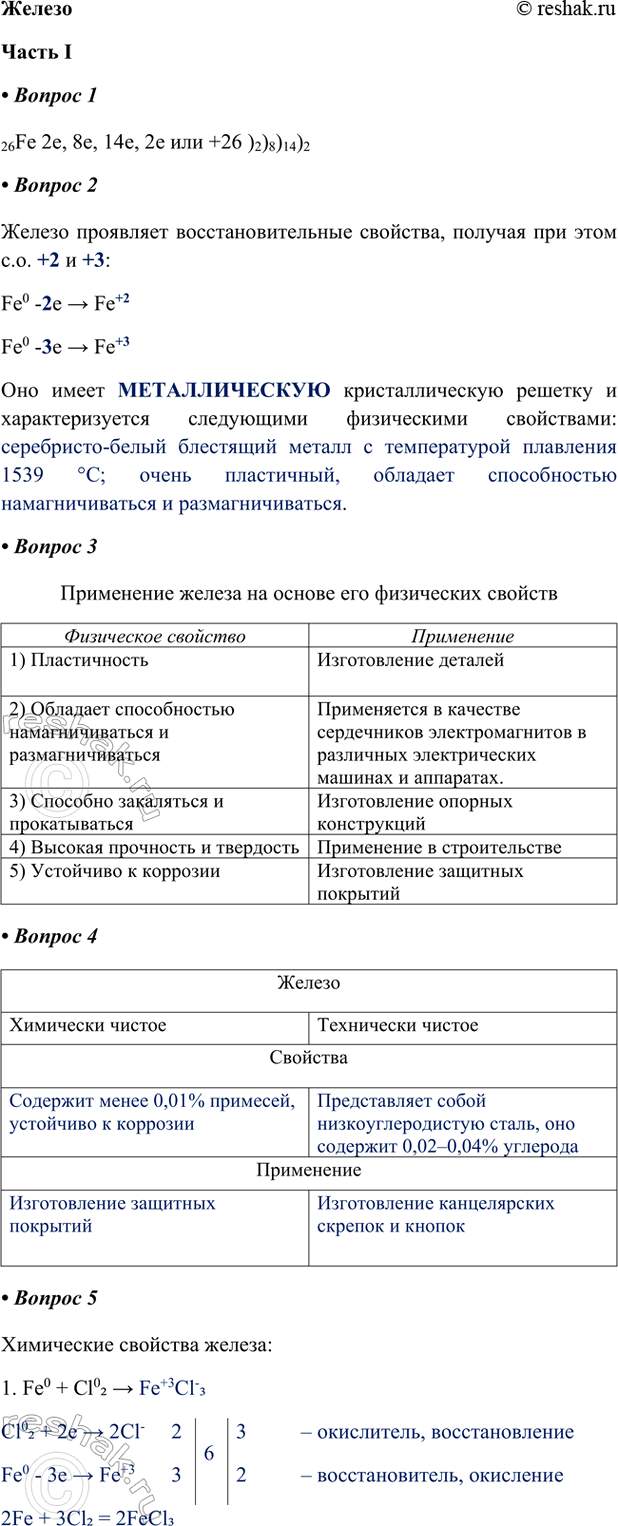
1. Дополните схему строения атома железа.
26Fe 2e, 8e, 14e, 2e или +26 )2)8)14)2
2. Железо проявляет восстановительные свойства, получая при этом с.о. +2 и +3:
Fe0 -2e > Fe+2
Fe0 -3e > Fe+3
Оно имеет МЕТАЛЛИЧЕСКУЮ кристаллическую решетку и характеризуется следующими физическими свойствами: серебристо-белый блестящий металл с температурой плавления 1539 °C; очень пластичный, обладает способностью намагничиваться и размагничиваться.
3. Заполните таблицу «Применение железа на основе его физических свойств».
ФИЗИЧЕСКОЕ СВОЙСТВО — ПРИМЕНЕНИЕ
Физическое свойство
1) Пластичность
2) Обладает способностью намагничиваться и размагничиваться
3) Способно закаляться и прокатываться
4) Высокая прочность и твердость
5) Устойчиво к коррозии
Применение
Изготовление деталей
Применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах.
Изготовление опорных конструкций
Применение в строительстве
Изготовление защитных покрытий
4. Железо
Химически чистое
Свойства
Содержит менее 0,01% примесей, устойчиво к коррозии
Применение
Изготовление защитных покрытий
Железо
Технически чистое
Свойства
Представляет собой низкоуглеродистую сталь, оно содержит 0,02–0,04% углерода
Применение
Изготовление канцелярских скрепок и кнопок
5. Химические свойства железа (рассмотрите с позиций окисления-восстановления).
1. Fe0 + Cl02 > Fe+3Cl-3
Cl02 + 2e > 2Cl- 2 6 3 – окислитель, восстановление
Fe0 - 3e > Fe+3 3 2 – восстановитель, окисление
2Fe + 3Cl2 = 2FeCl3
2. Fe0 + O02 > Fe+32O-23
O02 + 4e > 2O-2 4 12 3 – окислитель, восстановление
Fe0 - 3e > Fe+3 3 4 – восстановитель, окисление
4Fe + 3O2 = 2Fe2O3
3. Fe0 + S0 > Fe+2S-2
S0 + 2e > S-2 2 2 1 – окислитель, восстановление
Fe0 - 2e > Fe+2 2 1 – восстановитель, окисление
Fe + S = FeS
4. Fe0 + Cu+2SO4 > Cu0 + Fe+2SO4
Cu+2 + 2e > Cu0 2 2 1 – окислитель, восстановление
Fe0 - 2e > Fe+2 2 1 – восстановитель, окисление
Fe + CuSO4 = Cu + FeSO4
5. Fe0 + H+2SO4 > Fe+2SO4 + H02^
2H+ + 2e > H02 2 2 1 – окислитель, восстановление
Fe0 - 2e > Fe+2 2 1 – восстановитель, окисление
Fe + H2SO4 = FeSO4 + H2^
6. С водой взаимодействует при условии очень высокой температуры по уравнению:
3Fe + 4H2O = Fe3O4 + 4H2^
6. Установите соответствие между соединением и степенью окисления железа в нём.
НАЗВАНИЕ СОЕДИНЕНИЯ — СТЕПЕНЬ ОКИСЛЕНИЯ
Название
А) железная окалина
Б) хлористое железо
В) хлорное железо
Формула и степени окисления
Fe3O4 (Fe+2O· Fe+32O3)
Fe+2Cl2
Fe+3Cl3
А Б В
3 1 2
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









