Часть l Параграф 10 ГДЗ Рабочая тетрадь Габриелян Остроумов 8 класс (Химия)
Решение #1


Рассмотрим вариант решения задания из учебника Габриелян, Остроумов, Сладков 8 класс, Просвещение:
§ 10. Химические уравнения
Часть I
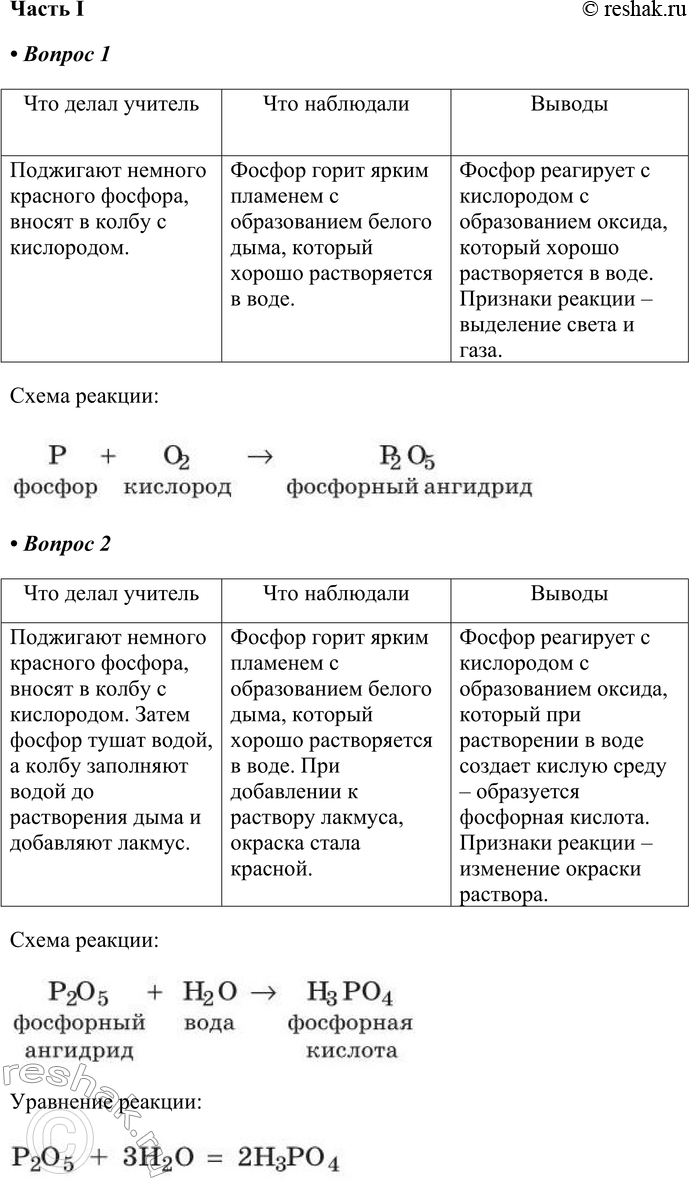
1. Оформите отчёт о демонстрационном опыте «Горение фосфора».
Что делал учитель Что наблюдали Выводы
Что делал учитель
Поджигают немного красного фосфора, вносят в колбу с кислородом.
Что наблюдали
Фосфор горит ярким пламенем с образованием белого дыма, который хорошо растворяется в воде.
Выводы
Фосфор реагирует с кислородом с образованием оксида, который хорошо растворяется в воде. Признаки реакции – выделение света и газа.
2. Оформите отчёт о выполненном демонстрационном опыте «Получение фосфорной кислоты».
Что делал учитель Что наблюдали Выводы
Схема реакции:_
Уравнение реакции:_
Что делал учитель
Поджигают немного красного фосфора, вносят в колбу с кислородом. Затем фосфор тушат водой, а колбу заполняют водой до растворения дыма и добавляют лакмус.
Что наблюдали
Фосфор горит ярким пламенем с образованием белого дыма, который хорошо растворяется в воде. При добавлении к раствору лакмуса, окраска стала красной.
Выводы
Фосфор реагирует с кислородом с образованием оксида, который при растворении в воде создает кислую среду – образуется фосфорная кислота. Признаки реакции – изменение окраски раствора.
3. Закон сохранения массы веществ: _
Фамилии авторов закона: _
Закон сохранения массы веществ: масса веществ, вступивших в химическую реакцию (реагентов), равна массе веществ, получившихся в результате ее (продуктов реакции).
Фамилии авторов закона: ЛОМОНОСОВ и ЛАВУАЗЬЕ.
4. Коэффициент реакции показывает_
Коэффициент реакции показывает соотношения молекул реагентов и продуктов реакции.
5. Оформите отчёт о выполненном лабораторном опыте «Доказательство справедливости закона сохранения массы веществ».
Что делали Что наблюдали Выводы и уравнения
Что делали
В стакан наливают несколько мл NaOH, добавляют 2 капли фенолфталеина и взвешивают на весах. В другой стакан наливают раствор H2SO4 и взвешивают на весах. Часть кислоты приливают к раствору щелочи. Снова взвешивают каждый из стаканов.
Что наблюдали
В растворе щелочи фенолфталеин окрасился в малиновый цвет. При добавлении кислоты, раствор снова обесцветился.
Схема реакции:
NaOH + H2SO4 > Na2SO4 + H2O
Суммарная масса реагентов оказалась равна суммарной массе продуктов реакции.
Выводы и уравнения
Щелочь и кислота реагируют с образованием соли и воды – признак химической реакции – изменение окраски индикатора.
Уравнение реакции:
2NaOH + H2SO4 > Na2SO4 + 2H2O
Тот факт, что масса веществ до и после реакции не изменилась, свидетельствует о справедливости закона сохранения массы.
6. Химическое уравнение — это _
Химическое уравнение – это условная запись химической реакции с помощью химических формул и математических знаков.
7. Уравнение химической реакции несёт следующую информацию
А) Какие вещества вступают в химическую реакцию и какие образуются в результате, а также соотношение числа их молекул (или формульных единиц)
Б) Тип химической реакции
8. На основе анализа уравнения Р2О5 + ЗН2О = 2Н3РО4 можно получить следующую информацию:
а) в реакцию вступают _ и _
б) в результате образуется _
в) _ молекула Р2О5 реагирует с _ молекулами Н2О, и образуется _ молекулы Н3РО4
А) в реакцию вступают оксид фосфора (P2O5) и вода (H2O)
Б) в результате образуется фосфорная кислота (H3PO4)
1 молекула P2O5 реагирует с 3 молекулами H2O, и образуется 2 молекулы H3PO4.
Похожие решебники
Популярные решебники 8 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.








