Часть l Параграф 6 ГДЗ Рабочая тетрадь Габриелян Остроумов 9 класс (Химия)
Решение #1

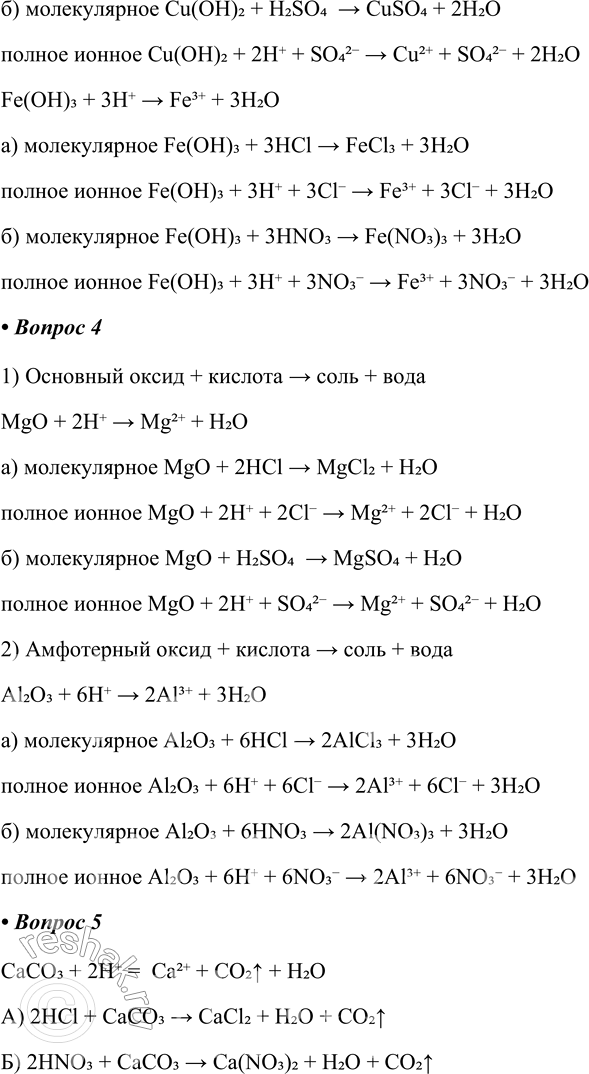

Рассмотрим вариант решения задания из учебника Габриелян, Остроумов, Сладков 9 класс, Просвещение:
§ 6. Химические свойства кислот как электролитов
Часть I
1. Общее уравнение диссоциации кислот:
HnAcd = ________ + _______
Общее уравнение диссоциации кислот:
HnAcd = nH+ + Acdn-
2. Изменение окраски индикаторов в кислой среде:
а) фиолетовый _ — > _
б) оранжевый _ - > _
Изменение окраски индикаторов в кислой среде:
а) фиолетовый лакмус > красный
б) оранжевый метилоранж > красный
3. Кислоты реагируют с основаниями.
1) Щёлочь + сильная кислота - > _
(реакция _)
Сокращённое ионное уравнение (в общем виде):
Примеры уравнений:
а) молекулярное
полное ионное
сокращённое ионное
б) молекулярное
полное ионное
сокращённое ионное
2) Нерастворимый гидроксид металла + кислота — >
Дано сокращённое ионное уравнение: Сu(ОН)2 + 2 = Сu2+ + 2. Составьте соответствующие уравнения:
а) молекулярное
полное ионное
б) молекулярное
полное ионное
Допишите сокращённое ионное уравнение: Fe(OH)3 + _______ = _______ +_______. Составьте соответствующие уравнения:
а) молекулярное
полное ионное
б) молекулярное
полное ионное
1) Щёлочь + сильная кислота > соль + вода
(реакция нейтрализации)
Сокращённое ионное уравнение (в общем виде):
OH- + H+ > H2O
Примеры уравнений:
а) молекулярное NaOH + HCl > NaCl + H2O
полное ионное Na+ + OH- + H+ + Cl- > Na+ + Cl- + H2O
сокращённое ионное OH- + H+ > H2O
б) молекулярное 2KOH + H2SO4 > K2SO4 + 2H2O
полное ионное 2K+ + 2OH- + 2H+ + SO42- > 2K+ + SO42- + 2H2O
сокращённое ионное OH- + H+ > H2O
2) Нерастворимый гидроксид металла + кислота > соль + вода
Cu(OH)2 + 2H+ > Cu2+ + 2H2O
а) молекулярное Cu(OH)2 + 2HCl > CuCl2 + 2H2O
полное ионное Cu(OH)2 + 2H+ + 2Cl- > Cu2+ + 2Cl- + 2H2O
б) молекулярное Cu(OH)2 + H2SO4 > CuSO4 + 2H2O
полное ионное Cu(OH)2 + 2H+ + SO42- > Cu2+ + SO42- + 2H2O
Fe(OH)3 + 3H+ > Fe3+ + 3H2O
а) молекулярное Fe(OH)3 + 3HCl > FeCl3 + 3H2O
полное ионное Fe(OH)3 + 3H+ + 3Cl- > Fe3+ + 3Cl- + 3H2O
б) молекулярное Fe(OH)3 + 3HNO3 > Fe(NO3)3 + 3H2O
полное ионное Fe(OH)3 + 3H+ + 3NO3- > Fe3+ + 3NO3- + 3H2O
4. Кислоты взаимодействуют с основными и амфотерными оксидами.
1) Основный оксид + кислота =____________+____________
Дано сокращённое ионное уравнение: MgO + 2 = ___________+____________. Составьте соответствующие уравнения:
а) молекулярное
полное ионное
б) молекулярное
полное ионное
2) Амфотерный оксид + кислота = ___________+____________
сокращённое ионное уравнение: Аl2О3 + 6 = ___________+____________. Составьте соответствующие уравнения:
а) молекулярное
полное ионное
б) молекулярное
полное ионное
1) Основный оксид + кислота > соль + вода
MgO + 2H+ > Mg2+ + H2O
а) молекулярное MgO + 2HCl > MgCl2 + H2O
полное ионное MgO + 2H+ + 2Cl- > Mg2+ + 2Cl- + H2O
б) молекулярное MgO + H2SO4 > MgSO4 + H2O
полное ионное MgO + 2H+ + SO42- > Mg2+ + SO42- + H2O
2) Амфотерный оксид + кислота > соль + вода
Al2O3 + 6H+ > 2Al3+ + 3H2O
а) молекулярное Al2O3 + 6HCl > 2AlCl3 + 3H2O
полное ионное Al2O3 + 6H+ + 6Cl- > 2Al3+ + 6Cl- + 3H2O
б) молекулярное Al2O3 + 6HNO3 > 2Al(NO3)3 + 3H2O
полное ионное Al2O3 + 6H+ + 6NO3- > 2Al3+ + 6NO3- + 3H2O
5. Кислоты взаимодействуют с солями, если образуется газ (^) или осадок (v).
Дано сокращённое ионное уравнение:
СаСО3 + 2 = ______ + ________^ + ______
Составьте соответствующие молекулярные уравнения:
Дано сокращённое ионное уравнение: SiO3 + 2 =
Составьте соответствующие молекулярные уравнения:
Дано сокращённое ионное уравнение: Ва2+ + SO2 - _______
Составьте соответствующие молекулярные уравнения
CaCO3 + 2H+ = Ca2+ + CO2^ + H2O
А) 2HCl + CaCO3 > CaCl2 + H2O + CO2^
Б) 2HNO3 + CaCO3 > Ca(NO3)2 + H2O + CO2^
SiO32- + 2H+ = H2SiO3v
А) H2SO4 + Na2SiO3 > Na2SO4 + H2SiO3v
Б) 2HNO3 + K2SiO3 > 2KNO3 + H2SiO3v
Ba2+ + SO42- > BaSO4v
А) BaCl2 + H2SO4 > BaSO4v + 2HCl
Б) Ba(NO3)2 + H2SO4 > BaSO4v + 2HNO3
6. Кислоты взаимодействуют с металлами, если
Дано сокращённое ионное уравнение
Zn + 2 = Zn2+ + _ ?
Составьте соответствующие молекулярные уравнения
Формулы кислот, не соответствующих этому ионному уравнению
Кислоты взаимодействуют с металлами, если:
- металл расположен в ряду активности левее водорода;
- в результате этой реакции должна образоваться растворимая соль;
- реагирующие вещества соприкасаются;
- концентрированная серная или азотная кислота не пассивирует металл;
- металл из-за высокой химической активности не вступает сразу в реакцию с водой.
Zn2+ + 2H+ > Zn2+ + H2
А) ZnCl2 + 2HCl > ZnCl2 + H2
Б) Zn(NO3)2 + 2HCl > ZnCl2 + 2HNO3
Формулы кислот, не соответствующих этому ионному уравнению: H2SO4 (конц.), HNO3 (конц.), H2CO3, H2SiO3.
7. Чтобы запомнить правило Бертолле, можно использовать такую схему:
Сформулируйте правило Бертолле.
Правило Бертолле: реакция между растворами электролитов возможна только в том случае, если в результате реакции образуется газ, осадок или слабый электролит (например, вода).
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.






