Параграф 41 ГДЗ Кузнецова Титова 8 класс (Химия)



Рассмотрим вариант решения задания из учебника Кузнецова, Титова 8 класс, Вентана-Граф:
Задание 1. Пользуясь таблицей 22, выявите периодические изменения свойств элементов, а также форм и свойств их соединений с возрастанием порядкового номера с 1-го по 20-й.
• Заряд атомов элементов и атомная масса возрастают монотонно, структуры внешнего электронного слоя изменяются скачкообразно.
• Формы и свойства оксидов и гидроксидов повторяются периодически.
• Валентность элементов по кислороду периодически повышается.
• Валентность элементов по водороду периодически убывает.
Задание 2. Какие характеристики элементов связывает между собой Периодический закон? Предложите схему причинно-следственных связей и их обоснование.
Периодический закон связывает между собой заряд ядра, массовое число, и как следствие, количество частиц, обуславливающие заряд и массу (протоны, электроны и нейтроны).
Массовое число зависит не только от протонов, но и от нейтронов, при этом число нейтронов может быть различным для разных атомов одного и того же элемента, что объясняет явление изотопии.
Заряд ядра – главная уникальная характеристика элемента, зависящая от количества протонов и определяющая свойства элемента. При этом, возрастание заряда ядра от первого до последнего элемента Периодической системы приводит периодическому повторению электронных структур атомов и числа электронов на внешнем энергетическом уровне.
1. Опишите важнейшие характеристики атомов элементов.
Заряд ядра (атомный порядковый номер в Периодической системе) – главная уникальная характеристика элемента, зависящая от количества протонов и определяющая свойства элемента.
Относительная атомная масса зависит от количества в атомном ядре протонов и нейтронов, при этом число нейтронов может быть различным для разных атомов одного и того же элемента, что объясняет явление изотопии.
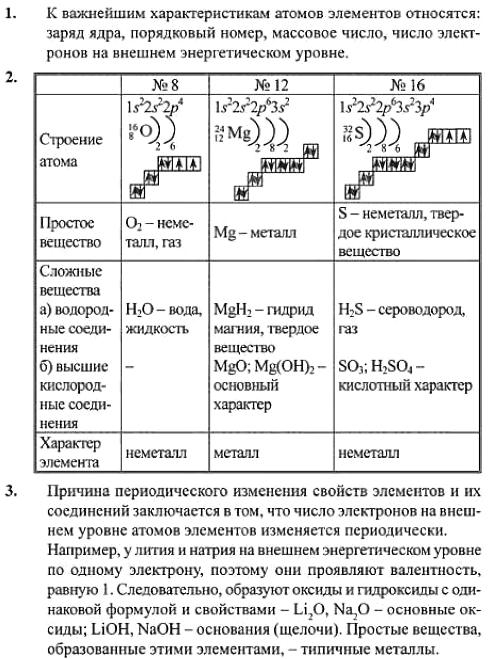
2. Дайте обобщённую характеристику одного из элементов: №8, 12 и 16 в периодической таблице в виде графической схемы.
3. В чём причина периодического изменения свойств элементов и их соединений? Ответ подтвердите примерами.
Периодическое изменение свойств элементов объясняется периодическим повторением числа электронов на внешнем энергетическом уровне и электронных структур атомов.
Например, каждый период начинается щелочным металлом, который имеет один электрон на внешнем уровне, его соединения проявляют явно выраженные основные свойства.
Слева направо по периоду начинается изменение количества внешних электронов, и как следствие, изменение свойств соединений элементов – например, кислотные свойства усиливаются. Так, соединения галогенов, имеющих на внешнем энергетическом уровне 7 электронов, проявляют явно выраженный кислотный характер.
4. Дайте современную трактовку периодического закона. Почему свойства элементов находятся в зависимости от заряда ядра атома элемента?
Современная формулировка Периодического закона: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда атома (порядкового номера элемента).
В отличие от атомной массы, которая может быть различной для атомов одного и того же элемента (явление изотопии), заряд ядра – главная уникальная характеристика элемента, зависящая от количества протонов и определяющая свойства элемента. Возрастание заряда ядра от первого до последнего элемента Периодической системы приводит периодическому повторению электронных структур атомов и числа электронов на внешнем энергетическом уровне.
5. Установите зависимость между изменением внешнего электронного слоя атомов элементов и характером этих элементов. Подтвердите её примерами.
С ростом числа электронов на внешнем энергетическом уровне основные свойства соединений элементов ослабевают, а кислотные – усиливаются.
Например, щелочные металлы (Li, Na, K, Rb, Cs) имеют один электрон на внешнем уровне, и их соединения проявляют явно выраженные основные свойства.
Соединения галогенов (F, Cl, Br, I), имеющих на внешнем энергетическом уровне 7 электронов, проявляют явно выраженный кислотный характер.
6. Почему заряд ядра атомов элемента считают главной характеристикой? Дайте развёрнутую аргументацию.
В отличие от атомной массы, которая может быть различной для атомов одного и того же элемента (явление изотопии), заряд ядра – главная характеристика элемента, его уникальное неповторяющееся свойство, зависящее от количества протонов и определяющее свойства соединений элемента. Возрастание заряда ядра от первого до последнего элемента Периодической системы приводит периодическому повторению электронных структур атомов и числа электронов на внешнем энергетическом уровне.
7. В чём сущность закона Мозли и какое значение он имеет для объяснения явления периодичности?
Закон Мозли говорит о том, что частота характеристического рентгеновского излучения химического элемента связана с его порядковым номером.
Закон Мозли подтвердил, что изменение Д.И. Менделеевым порядковых номеров некоторых элементов (например, Ar-K) соответствует последовательному увеличению зарядов атомных ядер, а не атомных масс, что подчеркнуло важнейшее влияние заряда ядра на электронную структуру элемента и свойства его соединений.
Популярные решебники 8 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.





