Параграф 37 ГДЗ Кузнецова Титова 8 класс (Химия)

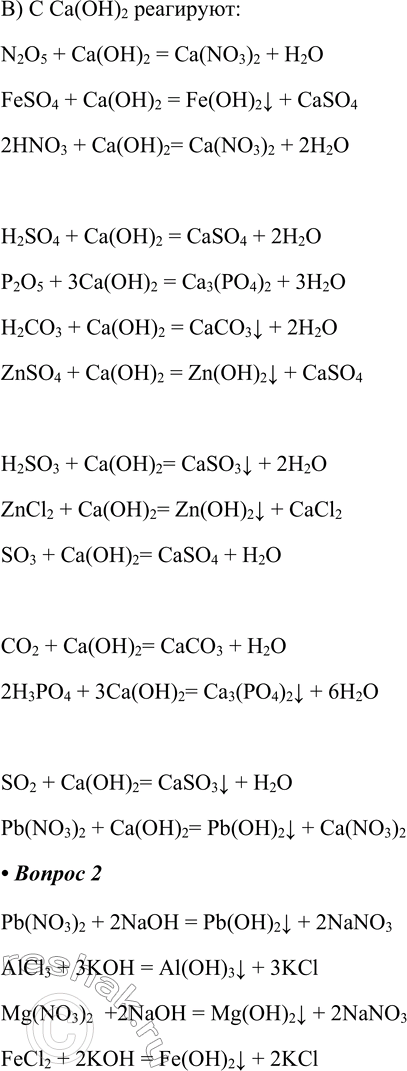

Рассмотрим вариант решения задания из учебника Кузнецова, Титова 8 класс, Вентана-Граф:
Рассмотрите рисунок 68 и постарайтесь устно описать порядок действий при выполнении лабораторного эксперимента. Выполните опыты: получение гидроксида меди (II) Сu(ОН)2, разложение
его при нагревании и взаимодействие Cu(ОН)2, с раствором H2SO4.
Составьте уравнения проведённых реакций:
1)Cu(OH)2v + H2SO4 = CuSO4 + 2H2O
Признак реакции: растворение студенисто-голубого осадка, образование раствора голубого цвета.
2)Cu(OH)2 = CuO + H2O
Признак реакции: образование порошка чёрного цвета и воды. Проделанные реакции отражают общие свойства нерастворимых оснований: их способность разлагаться при нагревании и взаимодействии с кислотами.
В пробирку наливают 1-2 мл раствора сульфата меди (II), с помощью пипетки добавляют несколько капель раствора гидроксида натрия. Наблюдают выпадение осадка синего цвета:
CuSO4 + 2NaOH = Cu(OH)2v + Na2SO4
Разделяют осадок на 2 пробирки. Одну из них нагревают над пламенем спиртовки. Наблюдают выпадение черного осадка оксида меди (II):
Cu(OH)2 = CuOv + H2O
Во вторую пробирку добавляют несколько капель серной кислоты. Наблюдают растворение осадка с образованием синего раствора сульфата меди (II):
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Проделанные реакции отражают общие свойства нерастворимых оснований: их способность разлагаться при нагревании и взаимодействовать с кислотами.
Рассмотрите схему опытов получения и исследования свойств гидроксида цинка (рис. 69). Какие действия вам придётся выполнить по ходу лабораторных опытов? Какова их цель? Целесообразность проведения одного из опытов (какого?) должна вызывать у вас сомнения.
В пробирку наливают 1-2 мл раствора хлорида цинка, с помощью пипетки добавляют несколько капель раствора гидроксида натрия. Наблюдают выпадение осадка серого цвета:
ZnCl2 + 2NaOH = Zn(OH)2v + 2NaCl
Разделяют осадок на 2 пробирки. В одну из них добавляют раствор гидроксида натрия до тех пор, пока осадок не растворится:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Во вторую пробирку добавляют несколько капель соляной кислоты. Наблюдают растворение осадка:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Проделанные реакции отражают общие свойства амфотерных гидроксидов: их способность взаимодействовать с кислотами и основаниями.
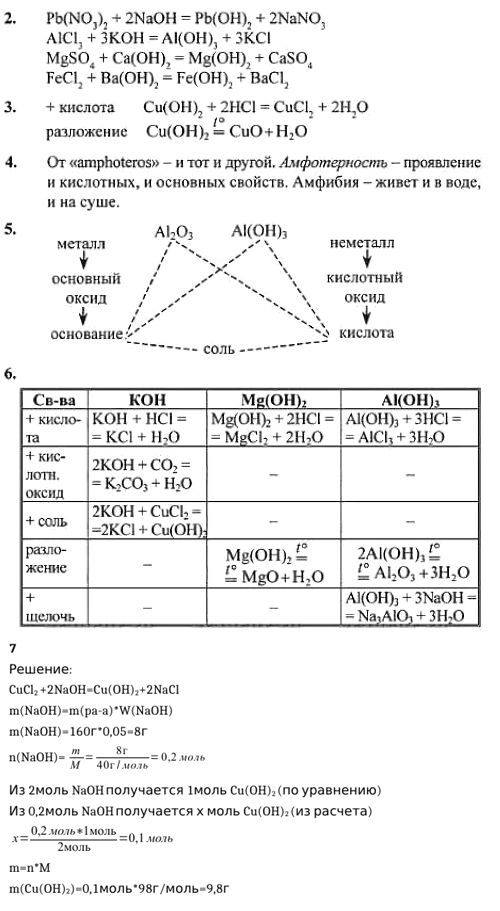
1. Из перечня формул малого химического тренажёра (см. табл. 20, с. 144) выберите формулы тех веществ, которые вступают в реакцию: а) с КОН; б) с Fe(OH)4; в) с Са(ОН)2. Составьте соответствующие уравнения реакций.
А) С KOH реагируют:
H2S + 2KOH = K2S + 2H2O
N2O5 + 2KOH = 2KNO3 + H2O
FeSO4 + 2KOH = Fe(OH)2v + K2SO4
HNO3 + KOH = KNO3 + H2O
H2SO4 + 2KOH = K2SO4 + 2H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O
H2CO3 + 2KOH = K2CO3 + 2H2O
ZnSO4 + 2KOH = Zn(OH)2v + K2SO4
H2SO3 + 2KOH = K2SO3 + 2H2O
ZnCl2 + 2KOH = Zn(OH)2v + 2KCl
SO3 + 2KOH = K2SO4 + H2O
CO2 + 2KOH = K2CO3 + H2O
H3PO4 + 3KOH = K3PO4 + 3H2O
SO2 + 2KOH = K2SO3 + H2O
Pb(NO3)2 + 2KOH = Pb(OH)2v + 2KNO3
Б) С Fe(OH)3 реагируют:
3HNO3 + Fe(OH)3 = Fe(NO3)3 + 3H2O
3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O
В) С Ca(OH)2 реагируют:
N2O5 + Ca(OH)2 = Ca(NO3)2 + H2O
FeSO4 + Ca(OH)2 = Fe(OH)2v + CaSO4
2HNO3 + Ca(OH)2= Ca(NO3)2 + 2H2O
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
P2O5 + 3Ca(OH)2 = Ca3(PO4)2 + 3H2O
H2CO3 + Ca(OH)2 = CaCO3v + 2H2O
ZnSO4 + Ca(OH)2 = Zn(OH)2v + CaSO4
H2SO3 + Ca(OH)2= CaSO3v + 2H2O
ZnCl2 + Ca(OH)2= Zn(OH)2v + CaCl2
SO3 + Ca(OH)2= CaSO4 + H2O
CO2 + Ca(OH)2= CaCO3 + H2O
2H3PO4 + 3Ca(OH)2= Ca3(PO4)2v + 6H2O
SO2 + Ca(OH)2= CaSO3v + H2O
Pb(NO3)2 + Ca(OH)2= Pb(OH)2v + Ca(NO3)2
2. Пользуясь таблицей растворимости, составьте уравнения реакций получения в лаборатории следующих нерастворимых оснований: Pb(OH)2, Al(OH)3, Mg(OH)2, Fe(OH)2.
Pb(NO3)2 + 2NaOH = Pb(OH)2v + 2NaNO3
AlCl3 + 3KOH = Al(OH)3v + 3KCl
Mg(NO3)2 +2NaOH = Mg(OH)2v + 2NaNO3
FeCl2 + 2KOH = Fe(OH)2v + 2KCl
3. Составьте уравнения реакций, отражающие химические свойства гидроксида меди (II).
Гидроксид меди (II) проявляет свойства нерастворимых оснований:
• Разлагается при нагревании:
Cu(OH)2 = CuOv + H2O
• Растворяется в растворе сильной кислоты:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
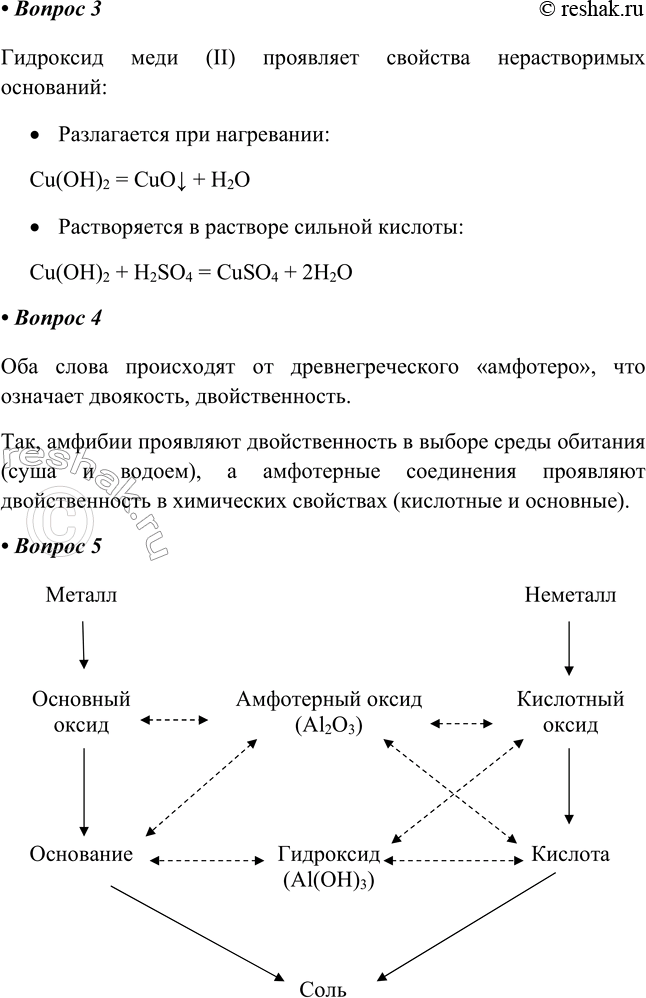
4. Объясните причины образования двух слов от одного корня: «амфотерность» и «амфибия».
Оба слова происходят от древнегреческого «амфотеро», что означает двоякость, двойственность.
Так, амфибии проявляют двойственность в выборе среды обитания (суша и водоем), а амфотерные соединения проявляют двойственность в химических свойствах (кислотные и основные).
5. Начертите в тетради схему генетической связи классов неорганических соединений и разместите в ней амфотерные соединения Al2О3 и Al(ОH)3. Пунктирными линиями обозначьте их химические свойства. Обсудите схему с товарищем.
6. Сравните химические свойства оснований: КОН, Mg(OH)2, Al(OH)s.
KOH – щелочь, реагирует с кислотными оксидами, кислотами и солями:
2KOH + CO2 = K2CO3 + H2O
KOH + HCl = KCl + H2O
2KOH + CuCl2 = 2KCl + Cu(OH)2v
Mg(OH)2 – нерастворимое основание, растворяется в сильных кислотах и разлагается при нагревании:
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
Mg(OH)2 = MgO + H2O
Al(OH)3 – амфотерный гидроксид, реагирует с кислотными оксидами, основаниями и кислотами:
2Al(OH)3 + 3N2O5 = 2Al(NO3)3 + 3H2O
Al(OH)3 + KOH = K[Al(OH)4]
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
7. Вычислите массу (г) гидроксида меди (II), образовавшуюся при реакции хлорида меди(II) с 160 г раствора гидроксида натрия с массовой долей NaOH 5%.
CuSO4 + 2NaOH = Cu(OH)2v + Na2SO4
m(NaOH)= m(раствора NaOH) · w(NaOH)/100%= 160·0,05=8 (г)
n(NaOH)=m/M=8/40= 0,2 (моль)
m(Cu(OH)2)= n· M=0,1· 98=9,8 (г)
Ответ. 9,8 г.
Популярные решебники 8 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.





