Часть I Параграф 36 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1

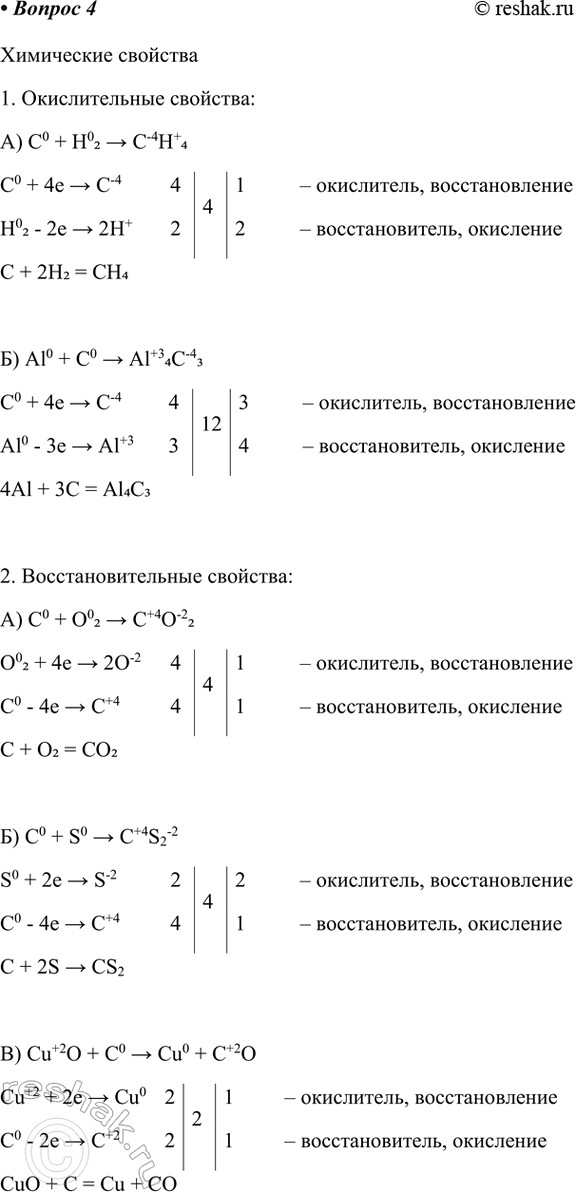

Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
УГЛЕРОД
Часть I
1. Строение атома: 6C 2e, 4e
2. Аллотропия
Параметры сравнения
Сходство
Различие
Алмаз
Образованы атомами углерода; атомная кристаллическая решетка; тугоплавкие.
Прозрачное кристаллическое вещество, самое твердое из всех природных веществ. В атомной кристаллической решетке каждый атом углерода окружен такими же атомами, расположенными в вершинах правильного тетраэдра. Кристаллы алмаза обычно бесцветные, но бывают синего, голубого, красного и черного цветов. Они имеют очень сильный блеск благодаря высокой светопреломляющей и светоотражающей способности.
Графит
Образованы атомами углерода; атомная кристаллическая решетка; тугоплавкие.
Темно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском; мягкий и непрозрачный, хорошо проводит теплоту и электрический ток. В кристаллической решетке атомы углерода, лежащие в одной плоскости, прочно связаны в правильные шестиугольники; связи между слоями малопрочны.
3. Аморфный углерод (сорта): КОКС; САЖА; ДРЕВЕСНЫЙ УГОЛЬ
Адсорбция – поглощение пористой поверхностью материала газов и растворенных веществ.
Активированная уголь (карболен) – древесный уголь, обработанный горячим водяным паром для увеличения поглотительной способности.
4. Химические свойства
Составьте уравнения реакций и рассмотрите их с позиций окисления-восстановления.
Окислительные свойства по отношению к Н2 и М:
А) C0 + H02 > C-4H+4
C0 + 4e > C-4 4 4 1 – окислитель, восстановление
H02 - 2e > 2H+ 2 2 – восстановитель, окисление
C + 2H2 = CH4
Б) Al0 + C0 > Al+34C-43
C0 + 4e > C-4 4 12 3 – окислитель, восстановление
Al0 - 3e > Al+3 3 4 – восстановитель, окисление
4Al + 3C = Al4C3
2) Восстановительные свойства по отношению к кислороду, другим более электроотрицательным НМ и сложным веществам:
А) C0 + O02 > C+4O-22
O02 + 4e > 2O-2 4 4 1 – окислитель, восстановление
C0 - 4e > C+4 4 1 – восстановитель, окисление
C + O2 = CO2
Б) C0 + S0 > C+4S2-2
S0 + 2e > S-2 2 4 2 – окислитель, восстановление
C0 - 4e > C+4 4 1 – восстановитель, окисление
C + 2S > CS2
В) Cu+2O + C0 > Cu0 + C+2O
Cu+2 + 2e > Cu0 2 2 1 – окислитель, восстановление
C0 - 2e > C+2 2 1 – восстановитель, окисление
CuO + C = Cu + CO
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









