Параграф 20 ГДЗ Кузнецова Титова 8 класс (Химия)





Рассмотрим вариант решения задания из учебника Кузнецова, Титова 8 класс, Вентана-Граф:
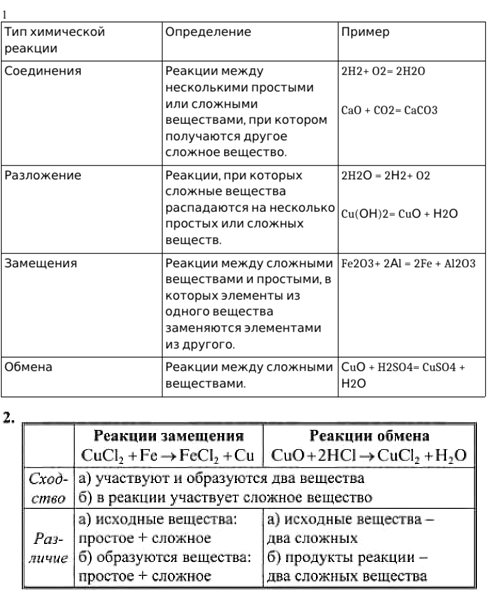
Задание 1. Ознакомившись с таблицей 9 и проделав предложенные лабораторные опыты, определите тип каждой реакции.
1. Заполняют пробирку свежеосажденным гидроксидом меди (II) (смешением растворов сульфата меди (II) и гидроксида натрия) и нагревают в держателе над спиртовкой.
CuSO4 + 2NaOH = Cu(OH)2v + Na2SO4
(сульфат меди (II) реагирует с гидроксидом натрия с образованием гидроксида меди (II) и сульфата натрия)
Наблюдается превращение синего осадка в черный, что свидетельствует о протекании химической реакции:
Cu(OH)2 = CuOv + H2O
(при нагревании гидроксида меди (II) образуется оксид меди (II) и вода)
Т.к. из одного сложного вещества образовалось несколько простых, это реакция разложения.
2. В раствор хлорида меди (II) опускают очищенный железный гвоздь. С течением времени гвоздь покрывается бурым налетом меди. Вынимают гвоздь и насыпают в раствор железные опилки. Наблюдается обесцвечивание голубого раствора хлорида меди (II) и образование бурого налета меди.
Изменение окраски и выделение осадка свидетельствуют о протекании химической реакции. При этом в обоих случаях происходила одна и та же реакция:
CuCl2 + Fe = FeCl2 + Cuv
Т.к. простое и сложное вещество прореагировали с образованием другого простого и другого сложного вещества, это реакция замещения.
В первом случае реакции проходила медленнее, т.к. эти реакции отличаются от предыдущих площадью поверхности реагентов – у опилок площадь больше, поэтому они реагируют быстрее, чем гвоздь.
3. К оксиду меди (II) приливают 5 мл раствора соляной кислоты. Наблюдается растворение осадка и изменение окраски раствора из бесцветной в голубую, что служит признаками химической реакции образования хлорида меди (II):
CuO + 2HCl = CuCl2 + H2O
Т.к. два сложных вещества прореагировали с образованием двух новых сложных веществ, это реакция обмена.
1. Приведите примеры и дайте определение реакциям замещения, разложения, присоединения, обмена.
Реакции соединения – это такие реакции, при которых из 2-х или более простых или сложных веществ образуется одно новое сложное вещество.
Реакции разложения – это такие реакции, при которых из одного сложного вещества получается 2 или более простых или сложных веществ.
Реакции замещения – это реакции между простым и сложным веществом, при которых атомы простого вещества замещают атомы одного из элементов сложного вещества.
Реакции обмена – это такие реакции, при которых 2 сложных вещества обмениваются своими составными частями.
CuO + 2HCl = CuCl2 + H2O
2. Приведите примеры и укажите сходство и различия в реакциях замещения и обмена.
Реакции замещения – это реакции между простым и сложным веществом, при которых атомы простого вещества замещают атомы одного из элементов сложного вещества.
Реакции обмена – это такие реакции, при которых 2 сложных вещества обмениваются своими составными частями.
CuO + 2HCl = CuCl2 + H2O
В отличие от реакции обмена, в реакциях замещения обязательно участвует и образуется простое вещество.
При этом в обоих типах в реакцию вступает 2 исходных вещества и образуется 2 продукта, а среди исходных веществ и продуктов обязательно присутствуют сложные вещества.
3. Расставьте коэффициенты в уравнениях реакций (там, где это необходимо), укажите, к какому типу относятся следующие химические реакции:
1) С + O2 - > CO2
2) СаСO3 - > СаО + СО2
3) Zn + НСl - > ZnCl2 + H2
4) NaOH + H2SO4 - > Na2SO4 + H2O
Химическое уравнение: C + O2 = CO2
Тип реакции: реакция соединения
Химическое уравнение: CaCO3 = CaO + CO2
Тип реакции: реакция разложения
Химическое уравнение: Zn + 2HCl = ZnCl2 + H2
Тип реакции: реакция замещения
Химическое уравнение: 2NaOH + H2SO4 = Na2SO4 + 2H2O
Тип реакции: реакция обмена
4. Объясните сущность химических реакций разных типов с позиций атомно-молекулярного учения.
С точки зрения атомно-молекулярного учения:
• В реакциях соединения атомы, входящие в состав исходных веществ, группируются в молекулы одного продукта реакции
• В реакциях разложения в молекулах исходного вещества разрушаются связи между атомами, в результате чего они группируются в более простые молекулы продуктов реакции
• В реакциях замещения атомы простого вещества вытесняют из молекулы сложного вещества атомы другого элемента
• В реакциях обмена в молекулах исходных сложных веществ разрушаются связи между атомами, но они перегруппировываются и образуют новые сложные вещества.
5. Рассчитайте массу (г) продукта реакции, образовавшегося при горении 1,5 моль фосфора в кислороде.
4P + 5O2 = 2P2O5
M(P2O5) = 31·2 + 16·5 = 142 (г/моль)
m(P2O5)= n· M=0,75· 142= 106,5 (г)
Ответ. 106,5 г.
6. Вычислите количество вещества (моль) углерода, вступившего в реакцию с кислородом, если в результате выделилось 4,4 г углекислого газа.
C+O2 > CO2^
M(CO2) = 12+16+16 = 44 (г/моль)
n(CO2)=m/M=4,4/44=0,1 (моль)
Ответ. 0,1 моль.
7. При взаимодействии 0,5 моль алюминия и серы можно получить сульфид алюминия Al2S3 масса которого
1) 3,75 г 2) 37,5 г 3) 30,5 г 4) 4 моль
2Al + 3S = Al2S3
M(Al2S3) = 27·2 + 32·3 = 150 (г/моль)
m(Al2S3)= n· M=0,25· 150= 37,5 (г)
Правильный ответ 2).
Ответ. 37,5 г.
8. Запишите уравнения реакций соединения, в результате которых образуются следующие вещества: 1) SO2; 2) CuO; 3) P2O5; 4) Fe2O3
1) S + O2 = SO2
2) 2Cu + O2 = 2CuO
3) 4P + 5O2 = 2P2O5
4) 4Fe + 3O2 = 2Fe2O3
9. Составьте и решите задачу, используя следующие физические величины: относительная молекулярная масса, масса, молярная масса, количество вещества.
Найти массу железной окалины, образовавшейся при прокаливании железа количеством вещества 0,5 моль. Рассчитать относительную молекулярную массу продукта прокаливания.
4Fe + 3O2 = 2Fe2O3
Относительная молекулярная масса:
Mr(Fe2O3) = 56·2 + 16·3 = 160 (а.е.м)
Молярная масса:
M(Fe2O3) = 56·2 + 16·3 = 160 (г/моль)
m(Fe2O3)= n· M=0,25· 160= 40 (г)
Ответ. 40 г, 160 а.е.м.
Популярные решебники 8 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.





