Часть l Параграф 2 ГДЗ Рабочая тетрадь Габриелян Остроумов 9 класс (Химия)
Решение #1



Рассмотрим вариант решения задания из учебника Габриелян, Остроумов, Сладков 9 класс, Просвещение:
§ 2. Классификация химических реакций
Часть I
1. Установите соответствие между типом химической реакции и её схемой.
ТИП РЕАКЦИИ
1) соединения
2) разложения
3) замещения
4) обмена
СХЕМА РЕАКЦИИ
A) АВ + С = АС + В
Б) АВ + CD = AD + СВ
B) А + В = АВ
Г) АВ = А + В
Признак, который положен в основу данной классификации реакций
Примеры реакций с участием простых и сложных веществ:
а) реакции соединения
б) реакции разложения
в) реакции замещения
г) реакции обмена
В основу классификации положены состав и число реагентов и продуктов реакции.
Примеры реакций с участием простых и сложных веществ.
а) Реакции соединения:
2Na + Cl2 > 2NaCl
2Mg + O2 > 2MgO
б) Реакции разложения:
2H2O > 2H2 + O2
CaCO3 > CaO + CO2
в) Реакции замещения:
Zn + CuSO4 > ZnSO4 + Cu
Fe + CuSO4 > FeSO4 + Cu
г) Реакции обмена:
NaCl + AgNO3 > NaNO3 + AgCl
HCl + NaOH > NaCl + H2O
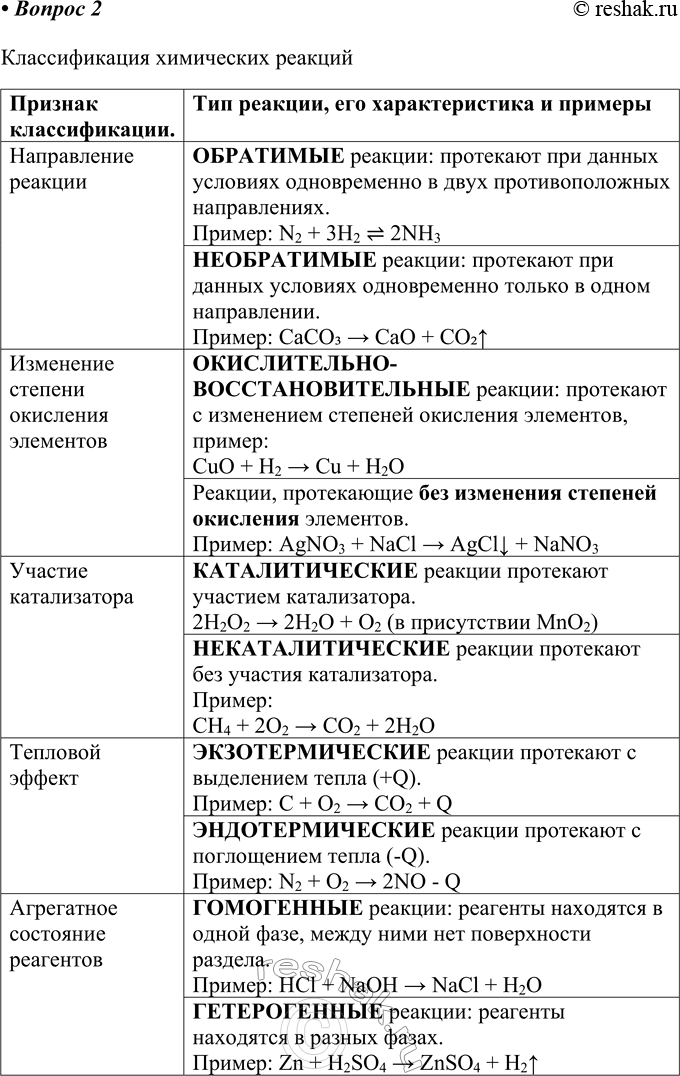
2. Заполните таблицу.
Классификация химических реакций
Признак классификации
Тип реакции, его характеристика и примеры
Направление реакции
_ реакции протекают при данных условиях одновременно в двух противоположных направлениях.
_ реакции протекают при данных условиях только в одном направлении.
Изменение степени окисления элементов
_ реакции протекают с изменением степеней окисления элементов.
_ реакции, протекающие без _ элементов.
Участие катализатора
_ реакции протекают с участием катализатора.
_ реакции протекают без участия катализатора.
Тепловой эффект
_ реакции протекают с выделением тепла (+Q).
_ реакции протекают с поглощением тепла (-Q).
Агрегатное состояние реагентов
_ реакции: реагенты находятся в одной фазе, между ними нет поверхности раздела. Пример:
_ реакции: реагенты находятся в разных фазах. Пример
3. Правила определения степеней окисления.
1) В простых веществах степень окисления элемента равна
2) В сложных веществах степень окисления:
а) отрицательная
б) положительная
— в бинарных соединениях у элемента с большей отрицательностью (её вычисляют по формуле 8 - N, где номер группы в Периодической системе)
— у водорода в соединениях с _ = -1
в) сумма степеней окисления всех атомов в молекуле или формульной единице равна
Правила определения степеней окисления.
В простых веществах степень окисления элемента равна 0 (нулю).
В сложных веществах степень окисления:
а) отрицательная
- у ФТОРА (-1),
- у КИСЛОРОДА (в оксидах = -2, в пероксидах = -1)
- у ВОДОРОДА в соединениях с металлами =-1
б) положительная
- в бинарных соединениях у элемента с большей электр-оотрицательностью (её вычисляют по формуле 8-N, где N — номер группы в Периодической системе)
- у водорода в соединениях с неметаллами +1
- у металлов IA-группы = +1
- у металлов IIA-группы = +2
- у металлов IIIA-группы = +3
В) сумма степеней окисления всех атомов в молекуле или формульной единице равна 0 (нулю).
4. Дополните схему реакции, укажите окислитель и восстановитель, расставьте коэффициенты с помощью метода электронного баланса.
а) НСl + Zn = ________ + Н2
б) Fe2O3 + _______ = Fe + Н2О
в) HNO3 + Mg = _________ + NO + Н2О
5. Установите соответствие между типом реакции и её характеристикой.
ТИП РЕАКЦИИ
А) реакция замещения
Б) реакция обмена
ХАРАКТЕРИСТИКА РЕАКЦИИ
1) протекает с изменением степени окисления реагентов и продуктов
2) протекает без изменения степени окисления регентов и продуктов
А Б
1 2
6. Установите соответствие между типом реакций и наиболее характерным для них тепловым эффектом.
ТИП РЕАКЦИЙ
ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ
А) реакции соединения 1) +Q
Б) реакции разложения 2) -Q
А Б
1 2
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.






