Страница 183 ГДЗ Рабочая тетрадь Габриелян 8 класс (Химия)
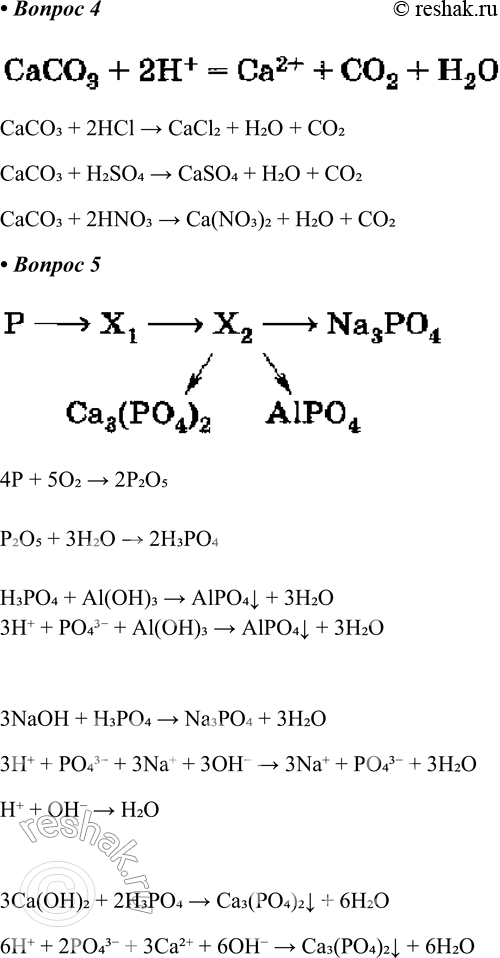

Рассмотрим вариант решения задания из учебника Габриелян 8 класс, Дрофа:
4. Приведите не менее трёх молекулярных уравнений, соответствующих следующему сокращённому ионному:
СаСО3 + 2Н+ = Са2+ + СО2 + Н2О.
CaCO3 + 2HCl > CaCl2 + H2O + CO2
CaCO3 + H2SO4 > CaSO4 + H2O + CO2
CaCO3 + 2HNO3 > Ca(NO3)2 + H2O + CO2
5. Определите неизвестные вещества и запишите молекулярные и ионные уравнения реакций, протекающих согласно схеме
4P + 5O2 > 2P2O5
P2O5 + 3H2O > 2H3PO4
H3PO4 + Al(OH)3 > AlPO4v + 3H2O
3H+ + PO43- + Al(OH)3 > AlPO4v + 3H2O
3NaOH + H3PO4 > Na3PO4 + 3H2O
3H+ + PO43- + 3Na+ + 3OH- > 3Na+ + PO43- + 3H2O
H+ + OH- > H2O
3Ca(OH)2 + 2H3PO4 > Ca3(PO4)2v + 6H2O
6H+ + 2PO43- + 3Ca+ + 6OH- > Ca3(PO4)2v + 6H2O
6. Сколько граммов 30%-й азотной кислоты потребуется для взаимодействия с 230 г известняка, содержащего 20% примесей? Какой объём углекислого газа (н. у.) при этом образуется?
Дано:
m(известняка) = 250 г
w(прим.) = 20%
w(HNO3) = 30%
M(CaCO3) = = 100 г/моль
M(HNO3) = 63 г/моль
Vm = 22,4 л/моль
m(раствора HNO3)=?
V(CO2)=?
CaCO3 + 2HNO3 > Ca(NO3)2 + H2O + CO2
w(CaCO3)=100%- w(прим.)=100%-20% = 80%
m(CaCO3)= m(известняка) · w(CaCO3)/100%= 250·0,8= 200 (г)
n(CH4)=m/M=200/100=2 (моль)
V(CO2)=n· Vm=2 ·22,4=44,8 (л)
m(HNO3)= n· M=4· 63= 252 (г)
Ответ. 44,8 л, 840 г.
Похожие решебники
Популярные решебники 8 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.








