Страницы 178-181 ГДЗ Рабочая тетрадь Габриелян 8 класс (Химия)


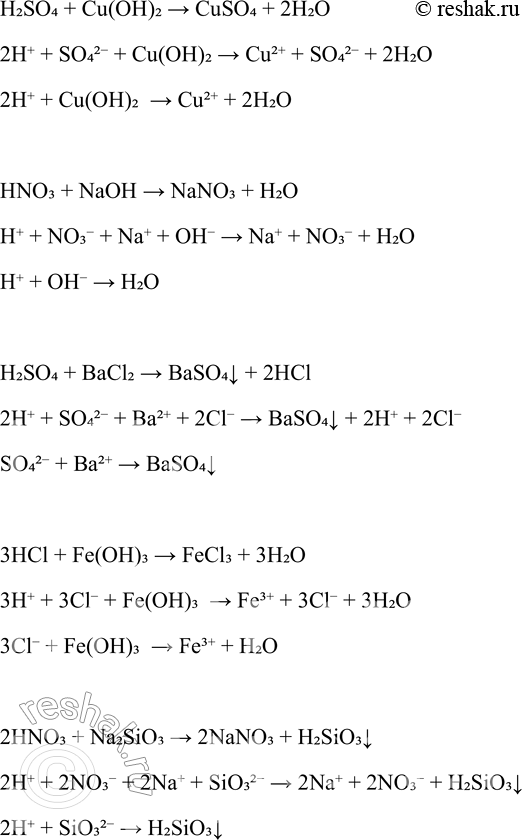
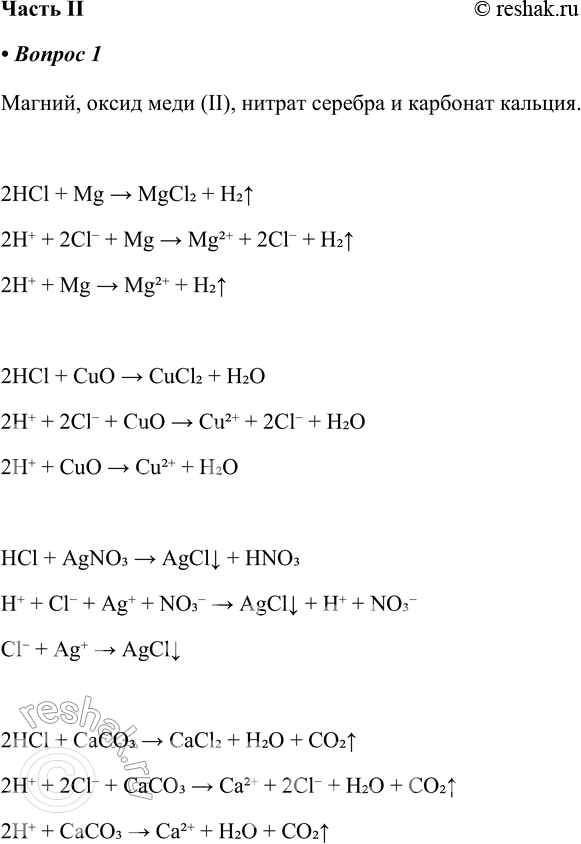
Рассмотрим вариант решения задания из учебника Габриелян 8 класс, Дрофа:
КИСЛОТЫ, ИХ КЛАССИФИКАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА В СВЕТЕ ТЭД
Часть I
1. Кислоты — это _
Кислоты – электролиты, которые диссоциируют на ионы водорода и анионы кислотного остатка.
2. Вспомните классификацию кислот и распределите кремниевую, соляную, азотную, угольную, фосфорную кислоты в соответствующие группы, вписав их формулы.
1) По числу атомов водорода
2) По наличию кислорода в кислотном остатке
3) По растворимости
4) По стабильности
5) По летучести
6) По степени диссоциации
По числу атомов водорода:
• Одноосновные (HCl, HNO3)
• Двухосновные (H2SiO3, H2CO3)
• Трехосновные (H3PO4)
По наличию кислорода в кислотном остатке:
• Бескислородные (HCl)
• Кислородсодержащие (HNO3, H2SiO3, H2CO3, H3PO4)
По растворимости:
• Растворимые (HCl, HNO3, H2CO3, H3PO4)
• Нерастворимые (H2SiO3)
По стабильности:
• Стабильные (HCl, HNO3, H3PO4)
• Нестабильные (H2CO3, H2SiO3)
По летучести:
• Летучие (HCl, HNO3)
• Нелетучие (H2SiO3, H2CO3, H3PO4)
По степени диссоциации:
• Сильные (HCl, HNO3)
• Слабые (H2SiO3, H2CO3, H3PO4)
3. Общие химические свойства кислот.
1) Кислота + _ — > соль + H2^
если:
2) Кислота + оксид металла — >
3) Кислота +
Если щёлочь, то это реакция _
4) Кислота +... — > новая
Общие химические свойства кислот.
1) Кислота + МЕТАЛЛ > соль + H2
Если:
• Металл не щелочной или щелочноземельный
• Образующаяся соль растворима
• Металл стоит до водорода в ряду напряжений
• Кислота не является азотной или серной концентрированной
2) Кислота + оксид металла > соль + вода
3) Кислота + основание > соль + вода
Если щелочь, то это реакции НЕЙТРАЛИЗАЦИИ.
4) Кислота + соль > новая кислота + новая соль
Если:
• Образуется более слабая кислота
• Образуется осадок или газ
4. Приведите примеры уравнений реакций, характеризующих общие свойства кислот, в молекулярном, полном ионном и сокращённом ионном видах
2HCl + Zn(OH)2 > ZnCl2 + 2H2O
2H+ + 2Cl- + Zn(OH)2 > Zn2+ + 2Cl- + 2H2O
2H+ + Zn(OH)2 > Zn2+ + 2H2O
H2SO4 + Cu(OH)2 > CuSO4 + 2H2O
2H+ + SO42- + Cu(OH)2 > Cu2+ + SO42- + 2H2O
2H+ + Cu(OH)2 > Cu2+ + 2H2O
HNO3 + NaOH > NaNO3 + H2O
H+ + NO3- + Na+ + OH- > Na+ + NO3- + H2O
H+ + OH- > H2O
H2SO4 + BaCl2 > BaSO4v + 2HCl
2H+ + SO42- + Ba2+ + 2Cl- > BaSO4v + 2H+ + 2Cl-
SO42- + Ba2+ > BaSO4v
3HCl + Fe(OH)3 > FeCl3 + 3H2O
3H+ + 3Cl- + Fe(OH)3 > Fe3+ + 3Cl- + 3H2O
3Cl- + Fe(OH)3 > Fe3+ + H2O
2HNO3 + Na2SiO3 > 2NaNO3 + H2SiO3v
2H+ + 2NO3- + 2Na+ + SiO32- > 2Na+ + 2NO3- + H2SiO3v
2H+ + SiO32- > H2SiO3v
Часть II
1. Соляная кислота взаимодействует со следующими из перечисленных веществ:
медь, магний, оксид меди (II), оксид кремния (IV), сульфат калия, нитрат серебра, карбонат кальция.
Запишите возможные уравнения реакций в молекулярном и ионном видах.
Магний, оксид меди (II), нитрат серебра и карбонат кальция.
2HCl + Mg > MgCl2 + H2^
2H+ + 2Cl- + Mg > Mg2+ + 2Cl- + H2^
2H+ + Mg > Mg2+ + H2^
2HCl + CuO > CuCl2 + H2O
2H+ + 2Cl- + CuO > Cu2+ + 2Cl- + H2O
2H+ + CuO > Cu2+ + H2O
HCl + AgNO3 > AgClv + HNO3
H+ + Cl- + Ag+ + NO3- > AgClv + H+ + NO3-
Cl- + Ag+ > AgClv
2HCl + CaCO3 > CaCl2 + H2O + CO2^
2H+ + 2Cl- + CaCO3 > Ca2+ + 2Cl- + H2O + CO2^
2H+ + CaCO3 > Ca2+ + H2O + CO2^
Похожие решебники
Популярные решебники 8 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.








