Страница 138 ГДЗ Рабочая тетрадь Габриелян 8 класс (Химия)
Рассмотрим вариант решения задания из учебника Габриелян 8 класс, Дрофа:
5. Вычислите массу гидроксида меди (II), который образуется при взаимодействии 200 г 20% -го раствора гидроксида натрия и избытка раствора сульфата меди (II). В результате реакции образуется также сульфат натрия.
РЕШЕНИЕ:
1) Вычислите массу растворённого вещества, ведь именно оно вступает в реакцию.
m(NaOH) = m раствора (NaOH) х w(NaOH)
m(NaOH) = _
2) Составьте уравнение химической реакции (коэффициенты!).
3) Рассчитайте количество вещества гидроксида натрия.
4) Вычислите количество вещества гидроксида меди (II).
5) Определите массу вещества гидроксида меди (II).
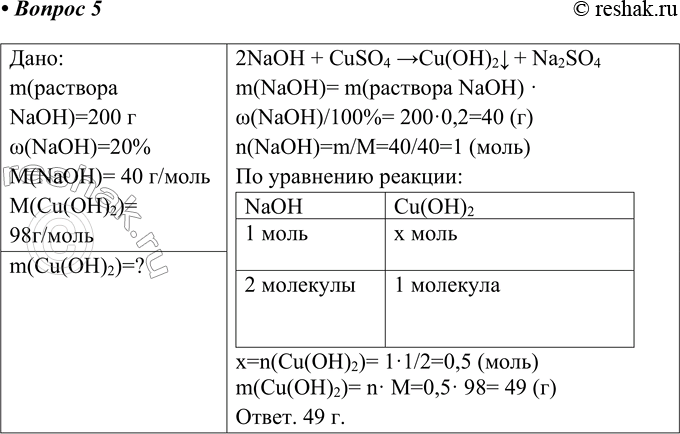
Дано:
m(раствора NaOH)=200 г
w(NaOH)=20%
M(NaOH)= 40 г/моль
M(Cu(OH)2)= 98г/моль
2NaOH + CuSO4 > Cu(OH)2v + Na2SO4
m(NaOH)= m(раствора NaOH) · w(NaOH)/100%= 200·0,2=40 (г)
n(NaOH)=m/M=40/40=1 (моль)
По уравнению реакции:
NaOH Cu(OH)2
1 моль x моль
2 молекулы 1 молекула
x=n(Cu(OH)2)= 1·1/2=0,5 (моль)
m(Cu(OH)2)= n· M=0,5· 98= 49 (г)
Ответ. 49 г.
Похожие решебники
Популярные решебники 8 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.








