Часть II Параграф 39 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1



Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
Часть II
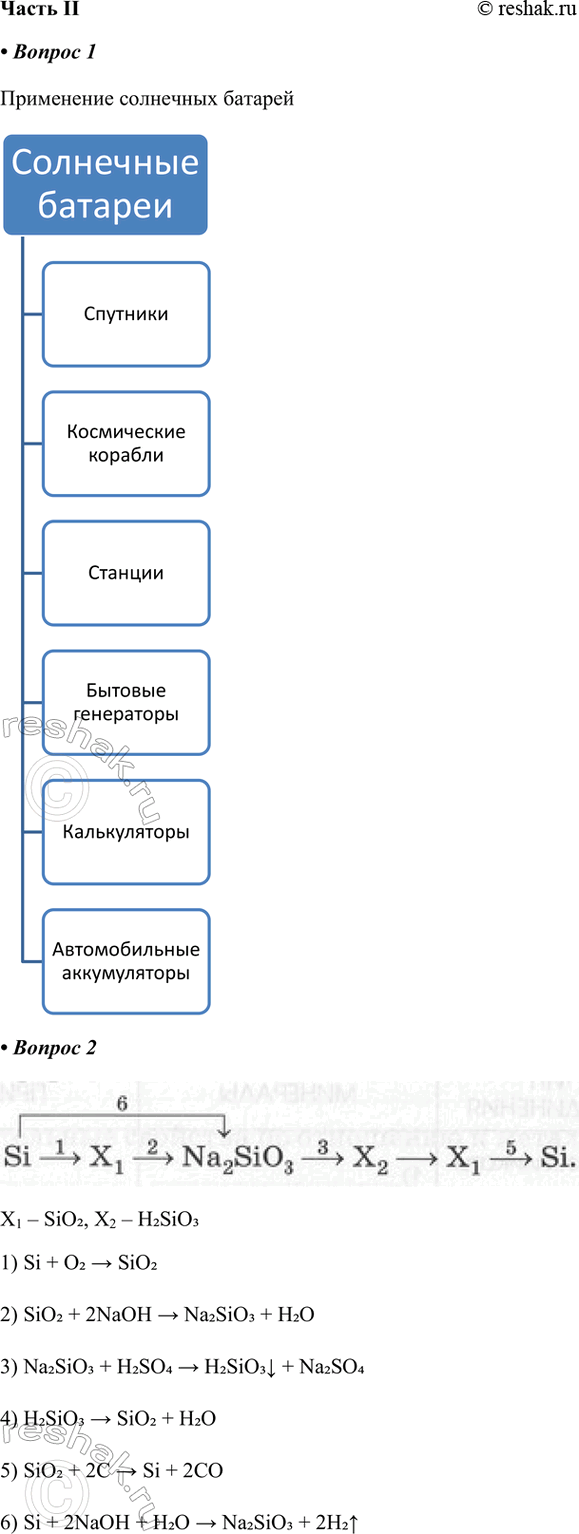
1. Заполните схему «Применение солнечных батарей»
2. Запишите уравнения реакций переходов, расшифровав неизвестные формулы:
Si > X1 > Na2SiO3 > X2 > X3 > Si
X1 – SiO2, X2 – H2SiO3
1) Si + O2 > SiO2
2) SiO2 + 2NaOH > Na2SiO3 + H2O
3) Na2SiO3 + H2SO4 > H2SiO3v + Na2SO4
4) H2SiO3 > SiO2 + H2O
5) SiO2 + 2C > Si + 2CO
6) Si + 2NaOH + H2O > Na2SiO3 + 2H2^
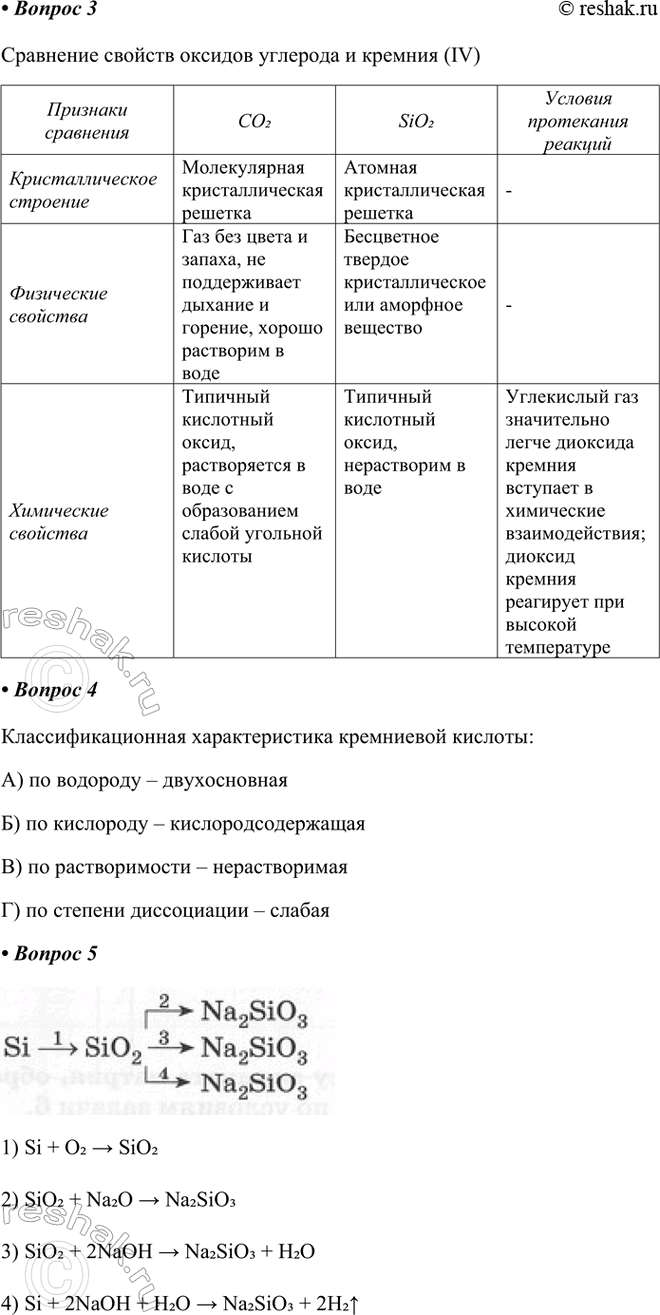
3. Заполните таблицу "Сравнение свойств оксидов углерода и кремния (IV)".
Признаки сравнения
Кристаллическое строение
Физические свойства
Химические свойства
CO2
Молекулярная кристаллическая решетка
Газ без цвета и запаха, не поддерживает дыхание и горение, хорошо растворим в воде
Типичный кислотный оксид, растворяется в воде с образованием слабой угольной кислоты
SiO2
Атомная кристаллическая решетка
Бесцветное твердое кристаллическое или аморфное вещество
Типичный кислотный оксид, нерастворим в воде
Условия протекания реакций
-
-
Углекислый газ значительно легче диоксида кремния вступает в химические взаимодействия; диоксид кремния реагирует при высокой температуре
4. Дайте классификационную характеристику кремниевой кислоты:
Классификационная характеристика кремниевой кислоты:
А) по водороду – двухосновная
Б) по кислороду – кислородсодержащая
В) по растворимости – нерастворимая
Г) по степени диссоциации – слабая
5. Запишите уравнения реакций переходов:
1) Si + O2 > SiO2
2) SiO2 + Na2O > Na2SiO3
3) SiO2 + 2NaOH > Na2SiO3 + H2O
4) Si + 2NaOH + H2O > Na2SiO3 + 2H2^
6. Какой объём водорода (н.у.) образуется при растворении в гидроксиде натрия 12,8 г кремния, содержащего 25% диоксида кремния?
Дано:
m(Si технич.)=12,8 г
w(прим.)=25%
M(Si)= 28 г/моль
Vm= 22,4 л/моль
V(H2)=?
Si + 2NaOH + H2O > Na2SiO3 + 2H2^
w(Si)=100%- w(прим.)==100%-25% = 75%
m(Si)= m(Si технич.) · w(Si)/100% = 12,8·0,75= 9,6 (г)
n(Si)=m/M=9,6/28=0,343 (моль)
x=n(H2)= 0,343·2/1= 0,686 (моль)
V(H2)=n· Vm=0,686 ·22,4=15,37 (л)
Ответ. 15,37 л.
7. С помощью одного реактива определите растворы трёх солей натрия: хлорида, карбоната, силиката. Запишите уравнения реакций в молекулярной и ионной формах.
1) HCl + NaCl > реакция не идет
H+ + Cl- + Na+ + Cl- > H+ + Cl- + Na+ + Cl-
2) 2HCl + Na2CO3 > 2NaCl + H2O + CO2^
2H+ + 2Cl- + 2Na+ + CO32- > 2Na+ + 2Cl- + H2O + CO2^
2H+ + CO32- > H2O + CO2^
3) 2HCl + Na2SiO3 > 2NaCl + H2SiO3v
2H+ + 2Cl- + 2Na+ + SiO32- > 2Na+ + 2Cl- + H2SiO3v
2H+ + SiO32- > H2SiO3v
8. Найдите массу силиката натрия, образовавшегося в результате реакции по условиям задачи 6.
Дано:
m(Si технич.)=12,8 г
w(SiO2)=25%
M(Si)= 28 г/моль
M(SiO2)= 60 г/моль
M(Na2SiO3)= 122 г/моль
m(Na2SiO3)=?
Si + 2NaOH + H2O > Na2SiO3 + 2H2^
w(Si)=100%- w(SiO2)==100%-25% = 75%
m(Si)= m(Si технич.) · w(Si)/100%= = 12,8·0,75= 9,6 (г)
n(Si)=m/M=9,6/28=0,343 (моль)
x=n(Na2SiO3)= 0,343·1/1= 0,343 (моль)
m(Na2SiO3)= n· M=0,343· 122=41,85 (г)
SiO2 + 2NaOH > Na2SiO3 + H2O
m(SiO2)= m(Si технич.) · w(SiO2)/100%= = 12,8·0,25= 3,2 (г)
n(SiO2)=m/M=3,2/60=0,053 (моль)
x=n(Na2SiO3)= 0,053·1/1= 0,053 (моль)
m(Na2SiO3)= n· M=0,053· 122=6,47 (г)
m(Na2SiO3)=41,85 + 6,47 = 48,32 (г)
Ответ. 48,32 г.
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









