Часть l Параграф 34 ГДЗ Рабочая тетрадь Габриелян Остроумов 9 класс (Химия)
Решение #1



Рассмотрим вариант решения задания из учебника Габриелян, Остроумов, Сладков 9 класс, Просвещение:
§ 34. Железо и его соединения
Часть I
1. Строение атома железа: 26Fe e, e, e, e. Железо — элемент _-группы
Железо – элемент VIIIБ-группы.
2. Степени окисления:
а) низшая: Fe - e — > Fe
б) высшая: Fe - е — > Fe
3. Физические свойства:
Серебристо-белый блестящий металл с температурой плавления 1536 °С. Очень пластичный, поэтому легко обрабатывается, куётся, штампуется. Железо способно намагничиваться и размагничиваться.
4. Химические свойства.
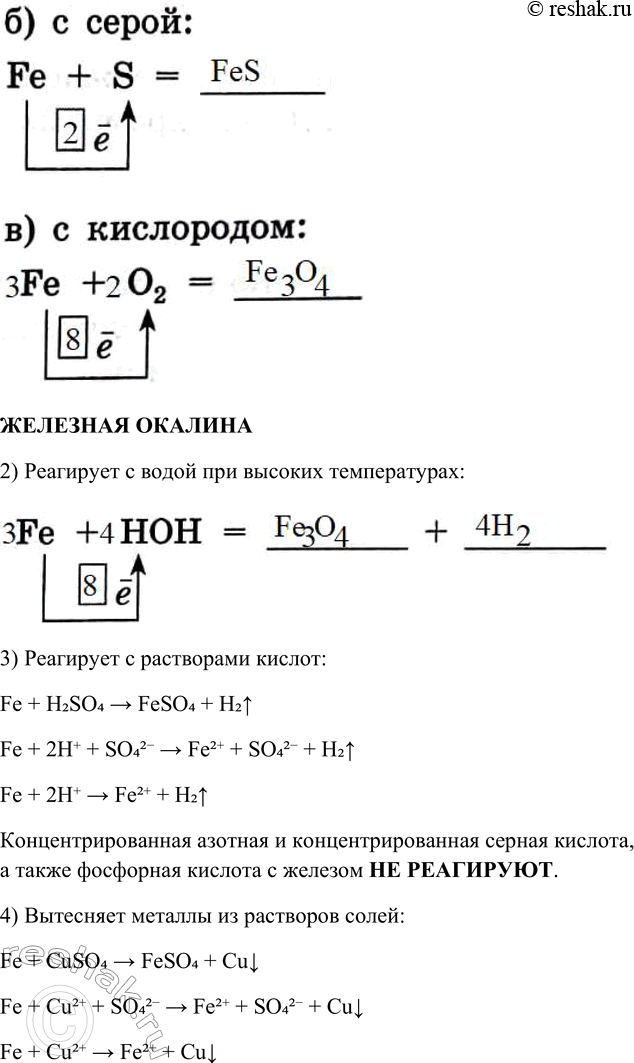
1) Реагирует с неметаллами:
а) с галогенами:
б) с серой:
Fe + Cl
в) с кислородом:
(название соединения)
2) Реагирует с водой при высоких температурах:
Fe + НОН = _ + _
3) Реагирует с растворами кислот:
Fe + H2SO4 = _ + _
Концентрированная азотная и концентрированная серная кислота, а также фосфорная кислота с железом __________________
4) Вытесняет металлы из растворов солей:
Fe + CuSO4 = __________ + ___________
3) Реагирует с растворами кислот:
Fe + H2SO4 > FeSO4 + H2^
Fe + 2H+ + SO42- > Fe2+ + SO42- + H2^
Fe + 2H+ > Fe2+ + H2^
Концентрированная азотная и концентрированная серная кислота, а также фосфорная кислота с железом НЕ РЕАГИРУЮТ.
4) Вытесняет металлы из растворов солей:
Fe + CuSO4 > FeSO4 + Cuv
Fe + Cu2+ + SO42- > Fe2+ + SO42- + Cuv
Fe + Cu2+ > Fe2+ + Cuv
5. Соединения железа в степени окисления +2.
1) Оксид железа _ — типичный основный оксид:
а) НСl + FeO = ________ + ________
б) SO3 + FeO = ____________
2) Гидроксид железа(II) — нерастворимое основание:
а) НСl + Fe(OH)2 = _________ +_________
б) Fe(OH) = _ + _
3) Сульфат железа(II) образует кристаллогидрат с формулой: __ (название) ___
4) Реактив на ионы Fe2+ — красная кровяная соль (пример уравнения):
Выпадает осадок________________________________ цвета.
1) Оксид железа FeO – типичный основный оксид:
А) FeO + 2HCl > FeCl2 + H2O
FeO + 2H+ + 2Cl- > Fe2+ + 2Cl- + H2O
FeO + 2H+ > Fe2+ + H2O
Б) FeO + SO3 > FeSO4
FeO + SO3 > Fe2+ + SO42-
2) Гидроксид железа Fe(OH)2 – нерастворимое основание:
А) Fe(OH)2 + 2HCl > FeCl2 + 2H2O
Fe(OH)2 + 2H+ + 2Cl- > Fe2+ + 2Cl- + 2H2O
Fe(OH)2 + 2H+ > Fe2+ + 2H2O
Б) Fe(OH)2 > FeO + H2O
3) Сульфат железа (II) образует кристаллогидрат с формулой: FeSO4·7H2O, железный купорос.
Выпадает осадок синего цвета.
6. Соединения железа в степени окисления +3.
1) Оксид железа(III)
а) H2SO4 + Fe2O3 = — амфотерный оксид:
б) NaOH + Fe2O3 =
2) Гидроксид железа(III) — нерастворимое основание:
а) НСl + Fe(OH)3 = _________ + _________
б) Fe(OH)3 = ____________
Получение Fe(OH)3
а) окислением Fe(OH)2:
Fe(OH)2 + О2 + Н2О - > Fe(OH)3
Расставьте коэффициенты в схеме реакции с помощью метода электронного баланса
б) реакцией обмена:
NaOH + FeCl3 = __________ +___________
3) Хлорид железа(ІІІ) — сильный восстановитель:
Fe + FeCl3 = __________
Си + FeCl3 = __________ + __________
4) Реактивы на ионы Fe3+:
а) жёлтая кровяная соль (пример уравнения):
(выпадает осадок__ цвета);
б) роданид калия (пример уравнения):
(выпадает осадок _____цвета).
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.






