Часть ll Параграф 24 ГДЗ Рабочая тетрадь Габриелян Остроумов 8 класс (Химия)
Решение #1


Рассмотрим вариант решения задания из учебника Габриелян, Остроумов, Сладков 8 класс, Просвещение:
Часть II
1. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
а) Fe - > FeCl2 - > FeCl3 - > Fe(OH)3 - > Fe2(SO4)3
Fe + 2HCl = FeCl2 + H2^
2FeCl2 + Cl2 = 2FeCl3
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
б) P - > P2O5 - > H3PO4 - > Ca3(PO4)2
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O
P2O5 + 3CaO = Ca3(PO4)2
2. Через 2 %-ный раствор известковой воды Са(ОН)2 пропустили 89,6 л углекислого газа. Рассчитайте объём известковой воды (р = 1,05 г/мл), который необходим для взаимодействия с указанным объёмом СО2. Определите количество вещества выпавшей в осадок соли и её массу.
Дано:
w(Ca(OH)2)=2%
p(раствора)=1,05 г/мл
V(CO2)=89,6 л
Vm= 22,4 л/моль
M(CaCO3)= 100 г/моль
M(Ca(OH)2)= 74г/моль
Ca(OH)2 + CO2 = CaCO3v + H2O
n(CO2)= V/Vm=89,6/22,4 = 4 (моль)
По уравнению реакции:
Ca(OH)2 CO2 CaCO3
x моль 4 моль y моль
1 молекула 1 молекула 1 молекула
x=n(Ca(OH)2)= 4 (моль)
y=n(CaCO3)= 4 (моль)
m(CaCO3) = n· M= 4· 100 = 400 (г)
m(Ca(OH)2) = n· M= 4· 74= 296 (г)
Ca(OH)2 296 г 2%
Раствор x г 100%
x=m(раствора)= 296 ·100/2=14800 (г)
V(раствора)=m/ p = 14800 / 1,05 = 14095 (мл) = 14,1 (л)
Ответ. 4 моль, 400 г, 14,1л.
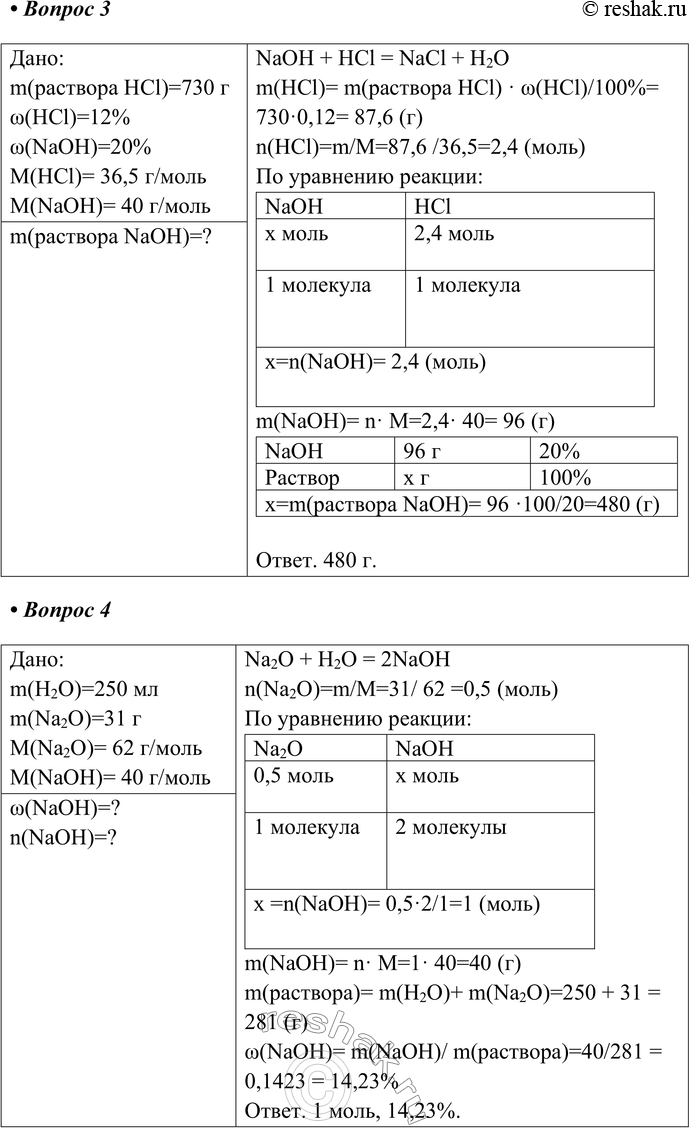
3. Рассчитайте массу 20 %-ного раствора едкого натра, необходимого для нейтрализации 12%-ной соляной кислоты массой 730 г.
Дано:
m(раствора HCl)=730 г
w(HCl)=12%
w(NaOH)=20%
M(HCl)= 36,5 г/моль
M(NaOH)= 40 г/моль
NaOH + HCl = NaCl + H2O
m(HCl)= m(раствора HCl) · w(HCl)/100%= 730·0,12= 87,6 (г)
n(HCl)=m/M=87,6 /36,5=2,4 (моль)
По уравнению реакции:
NaOH HCl
x моль 2,4 моль
1 молекула 1 молекула
x=n(NaOH)= 2,4 (моль)
m(NaOH)= n· M=2,4· 40= 96 (г)
NaOH 96 г 20%
Раствор x г 100%
x=m(раствора NaOH)= 96 ·100/20=480 (г)
Ответ. 480 г.
4. В 250 г воды растворили 31 г оксида натрия. Рассчитайте массовую долю и количество вещества щёлочи в полученном растворе.
Дано:
m(H2O)=250 мл
m(Na2O)=31 г
M(Na2O)= 62 г/моль
M(NaOH)= 40 г/моль
Na2O + H2O = 2NaOH
n(Na2O)=m/M=31/ 62 =0,5 (моль)
По уравнению реакции:
Na2O NaOH
0,5 моль x моль
1 молекула 2 молекулы
x =n(NaOH)= 0,5·2/1=1 (моль)
m(NaOH)= n· M=1· 40=40 (г)
m(раствора)= m(H2O)+ m(Na2O)=250 + 31 = 281 (г)
w(NaOH)= m(NaOH)/ m(раствора)=40/281 = 0,1423 = 14,23%
Ответ. 1 моль, 14,23%.
5. С какими из веществ будет взаимодействовать гидроксид натрия?
1) АlСl3
2) KNO3
3) Са(ОН)2
4) H2SiO3
5) CuO
Запишите уравнения реакций.
3NaOH + AlCl3 = 3NaCl + Al(OH)3v
2NaOH +H2SiO3 = Na2SiO3 + 2H2O
Ответ. 14.
6. Из предложенного перечня выберите две пары веществ, между которыми возможно взаимодействие:
1) оксид магния и оксид меди(ІІ)
2) гидроксид магния и серная кислота
3) сульфат магния и гидроксид калия
4) хлорид магния и кремниевая кислота
5) гидроксид магния и оксид железа(III)
Запишите уравнения реакций.
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
MgSO4 + 2KOH = Mg(OH)2v + K2SO4
Ответ. 23.
7. Установите соответствие между веществом и реагентами, с каждым из которых это вещество взаимодействует.
ВЕЩЕСТВО
1) ВаО
2) SO3
3) НСl
4) NaOH
РЕАГЕНТЫ
A) Н2О, КОН
Б) Сu(ОН)2, К2О
B) H2SiO3, FeCl3
Г) HNO3, AgNO3
Д) SO3, H2SO4
1 2 3 4
Д А Б В
Похожие решебники
Популярные решебники 8 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.








