Часть II Параграф 14 ГДЗ Рабочая тетрадь Габриелян Остроумов 11 класс (Химия)


Рассмотрим вариант решения задания из учебника Габриелян, Остроумов, Сладков 11 класс, Просвещение:
Часть II
• Вопрос 1
В ряду соединений, формулы которых: SO2, SO3, H2S, H2SO4, Na2SO4, SF4, FeS
1) сера является только окислителем в веществах: S+6O3 (оксид серы(VI)), H2S+6O4 (серная кислота), Na2S+6O4 (сульфат натрия), S+6F6 (фторид серы(VI))
2) сера является только восстановителем в веществах: H2S-2 (сероводород), FeS-2 (сульфид железа(II))
3) сера является и окислителем и восстановителем в веществах: S+4O2 (оксид серы(IV))
• Вопрос 2
Допишите продукты реакций, расставьте коэффициенты методом электронного баланса, определите окислитель и восстановитель, процессы окисления и восстановления.
1) Cu + HNO3 > Cu(NO3)2 + NO + H2O
N+5 + 3e > N+2 3 6 2 – окислитель, восстановление
Cu0 - 2e > Cu+2 2 3 – восстановитель, окисление
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2) NH3 + CuO > N2 + H2O + Cu
Cu+2 + 2e > Cu0 2 6 3 – окислитель, восстановление
2N-3 - 6e > N20 6 1 – восстановитель, окисление
2NH3 + 3CuO = N2 + 3Cu + 3H2O
3) FeCl2 + Cl2 > FeCl3
Cl20 + 2e > 2Cl- 2 2 1 – окислитель, восстановление
Fe+2 - e > Fe+3 1 2 – восстановитель, окисление
2FeCl2 + Cl2 = 2FeCl3
• Вопрос 3
Найдите объем сернистого газа (н. у.), полученного при растворении в концентрированной серной кислоте 320 мг меди, содержащей 5 % примесей.
Дано:
m(Cu технич.)= 320 мг = 0,32 г
w(прим.)=5%
M(Cu)= 64 г/моль
Vm= 22,4 л/моль
V(SO2)=?
Cu + 2H2SO4(конц.) > CuSO4 + SO2^ + 2H2O
w(Cu)=100%- w(прим.)=100%-5% = 95%
m(Cu)= m(Cu технич.) · w(Cu)/100%= 0,32·0,95= 0,304 (г)
n(Cu)=m/M= 0,304/64= 0,00475 (моль)
По уравнению реакции:
Cu SO2
0,00475 моль x моль
1 молекула 1 молекула
x=n(SO2)= 0,00475 (моль)
V(SO2)=n· Vm=0,00475·22,4=0,1064 (л)
Ответ. 0,1064 л.
• Вопрос 4
Выберите ряд, в котором представлены характерные степени окисления хлора.
1) -1, +1, +3, +5, +7
2) -2, +2, +4, +6
3) -1, -3, +3, +4, +7
4) -1, +2, +3, +6, +7
Поясните свой выбор.
Характерные степени окисления хлора: -1, +1, +3, +5, +7
Ответ. 1.
Хлор проявляет эти степени окисления в своих соединениях: HCl-, NaCl+O, NaCl+3O2, NaCl+5O3, NaCl+7O4
• Вопрос 5
Установите соответствие между схемой реакции и изменением степени окисления окислителя.
СХЕМА РЕАКЦИИ
А) MnO2 + H2SO4 > MnSO4 + O2 + H2O
Б) Mn(OH)2 + O2 > MnO2 + H2O
В) KMnO4 + K2SO3 + KOH > K2MnO4 + K2SO4 + H2O
Г) KMnO4 + H2O2 > MnO2 + O2 + KOH + H2O
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ
1) Mn+7 > Mn+4
2) Mn+2 > Mn+4
3) O02 > 2O-2
4) 2O-1 > O20
5) Mn+7 > Mn+6
6) Mn+4 > Mn+2
А) Mn+4O2 + H2SO4 > Mn+2SO4 + O2 + H2O
Mn+4 > Mn+2
Ответ 6
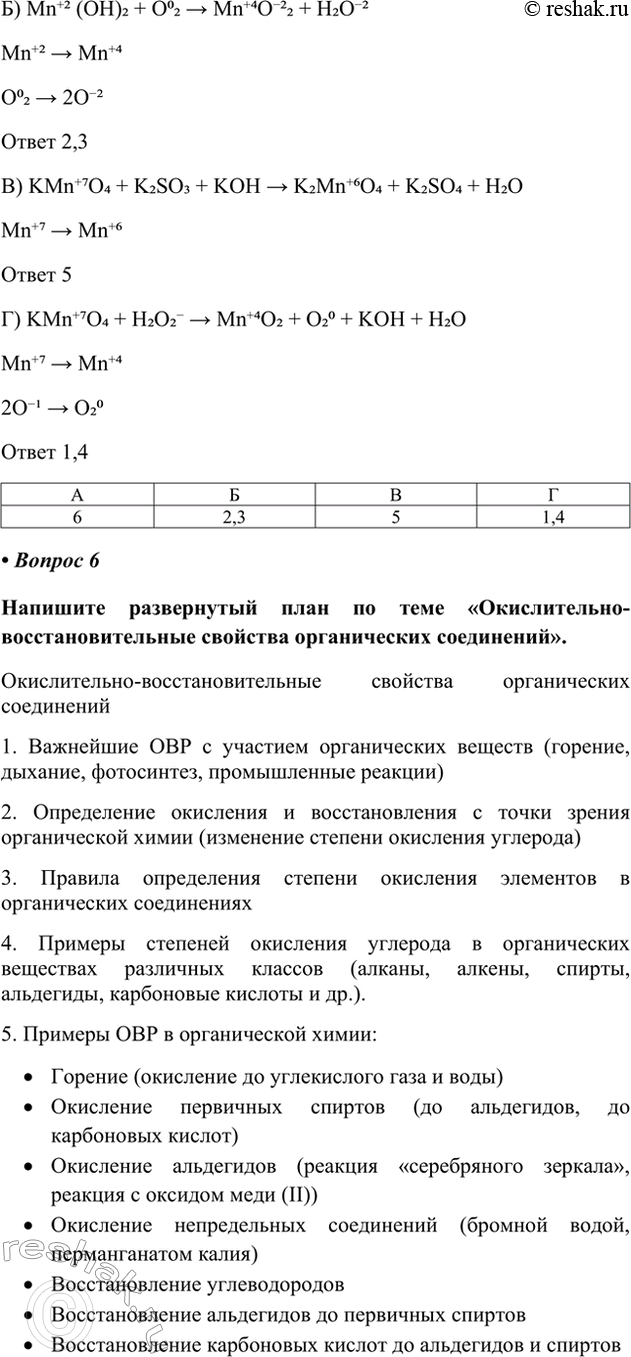
Б) Mn+2 (OH)2 + O02 > Mn+4O-22 + H2O-2
Mn+2 > Mn+4
O02 > 2O-2
Ответ 2,3
В) KMn+7O4 + K2SO3 + KOH > K2Mn+6O4 + K2SO4 + H2O
Mn+7 > Mn+6
Ответ 5
Г) KMn+7O4 + H2O2- > Mn+4O2 + O20 + KOH + H2O
Mn+7 > Mn+4
2O-1 > O20
Ответ 1,4
А Б В Г
6 2,3 5 1,4
• Вопрос 6
Напишите развернутый план по теме «Окислительно-восстановительные свойства органических соединений».
Окислительно-восстановительные свойства органических соединений
1. Важнейшие ОВР с участием органических веществ (горение, дыхание, фотосинтез, промышленные реакции)
2. Определение окисления и восстановления с точки зрения органической химии (изменение степени окисления углерода)
3. Правила определения степени окисления элементов в органических соединениях
4. Примеры степеней окисления углерода в органических веществах различных классов (алканы, алкены, спирты, альдегиды, карбоновые кислоты и др.).
5. Примеры ОВР в органической химии:
• Горение (окисление до углекислого газа и воды)
• Окисление первичных спиртов (до альдегидов, до карбоновых кислот)
• Окисление альдегидов (реакция «серебряного зеркала», реакция с оксидом меди (II))
• Окисление непредельных соединений (бромной водой, перманганатом калия)
• Восстановление углеводородов
• Восстановление альдегидов до первичных спиртов
• Восстановление карбоновых кислот до альдегидов и спиртов
Похожие решебники
Популярные решебники 11 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









