Страницы 167-170 ГДЗ Рабочая тетрадь Габриелян 8 класс (Химия)



Рассмотрим вариант решения задания из учебника Габриелян 8 класс, Дрофа:
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД)
Часть I
1. Электролиты — это _
Признаки электролитов:
— состоят из _;
— растворяются в _.
Электролиты – вещества, растворы которых проводят электрический ток.
Признаки электролитов:
• состоят из ИОНОВ
• растворяются в ВОДЕ
2. Диссоциация — это _
Диссоциация – это процесс распада электролита на ионы.
3. Основные положения ТЭД.
1) По способности проводить электрический ток в растворах
все вещества делятся на
электролиты
1) Щёлочи
2) Растворимые кислоты
3) Растворимые соли
неэлектролиты
1) Нерастворимые основания
2) Нерастворимая
3) _ соли
4) Оксиды
5) Многие органические вещество
6) Простые вещества
2) В растворах электролиты _ на _, т.е. _. Ионы различают.
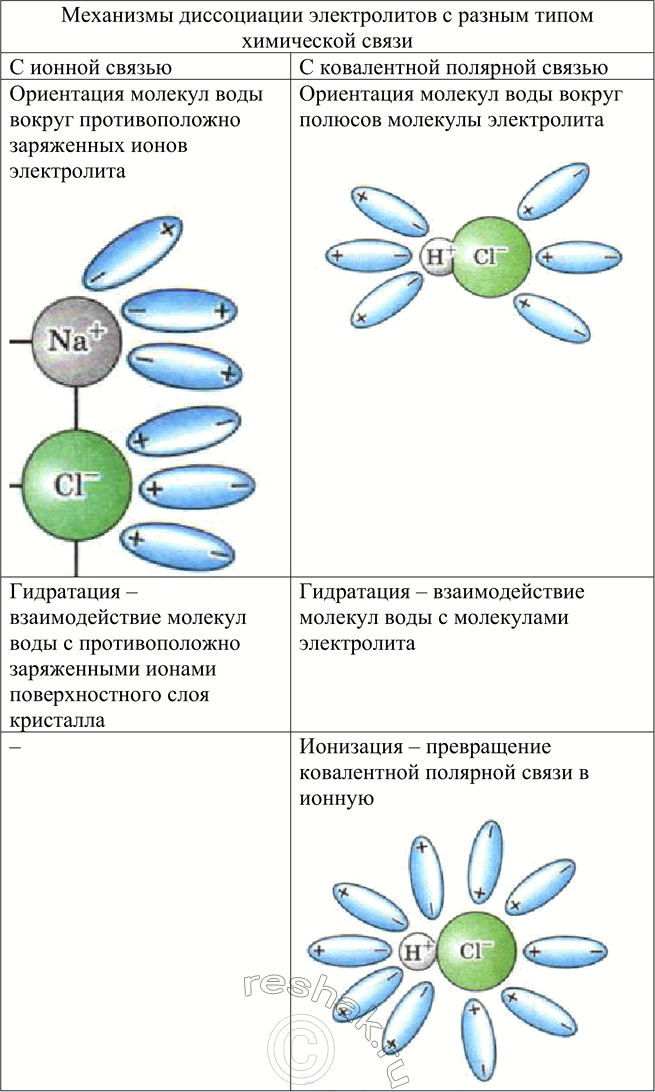
Механизмы диссоциации электролитов с разным типом химической связи
ЭЛЕКТРОЛИТЫ С ИОНННОЙ СВЯЗЬЮ (ЩЁЛОЧИ, СОЛИ)
Ориентация молекул воды вокруг противоположно заряженных ионов электролита
Гидратация —
Диссоциация —
ЭЛЕКТРОЛИТЫ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮ (КИСЛОТЫ)
Ориентация
Гидратация —
Ионизация — превращение ковалентной полярной связи в ионную
Диссоциация —
3) Разные электролиты, по-разному диссоциируют на ионы, что характеризует степень электролитической диссоциации — _:
кол-во в-ва электролита, распавшегося на ионы
кол-во в-ва растворенного вещества
По а электролиты делятся на
слабые диссоциируют
сильные диссоциируют
а зависит:
— от природы электролита, на п р и м е р:
— от разбавления (как?)
разные электролиты по-разному диссоциируют на ионы, что характеризует степень электролитической диссоциации – a
По a электролиты делятся на:
Слабые – диссоциируют ОБРАТИМО
1) H2S
2) H2SO3
3) H2CO3
Сильные – диссоциируют НЕОБРАТИМО
1) KOH
2) NaCl
3) H2SO4
a зависит:
- от природы электролита, например: у растворимой сильной кислоты HCl a=1, у нерастворимой слабой H2SiO3 a < 0,03
- от разбавления: чем больше разбавление, тем больше a
4) Как электролиты, все вещества делятся на три класса.
а) Кислоты — это электролиты, которые диссоциируют на _ и _.
б) Основания — _
Ва(ОН)2 = _
в) Соли — _
Как электролиты, все вещества делятся на три класса.
а) Кислоты – это электролиты, которые диссоциируют на КАТИОНЫ ВОДОРОДА и АНИОНЫ КИСЛОТНОГО ОСТАТКА:
HNO3 > H+ + NO3-
H2SO4 > 2H+ + SO42-
б) Основания – это электролиты, которые диссоциируют на катионы металла и гидроксид-анионы:
KOH > K+ + OH-
Ba(OH)2 > Ba2+ + 2OH-
в) Соли – это электролиты, которые диссоциируют на катионы металла и анионы кислотного остатка:
Fe(NO3)3 > Fe3+ + 3NO3-
AlCl3 > Al3+ + 3Cl-
Похожие решебники
Популярные решебники 8 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.








