Практическая работа 4 ГДЗ Кузнецова Титова 9 класс (Химия)
Решение #1
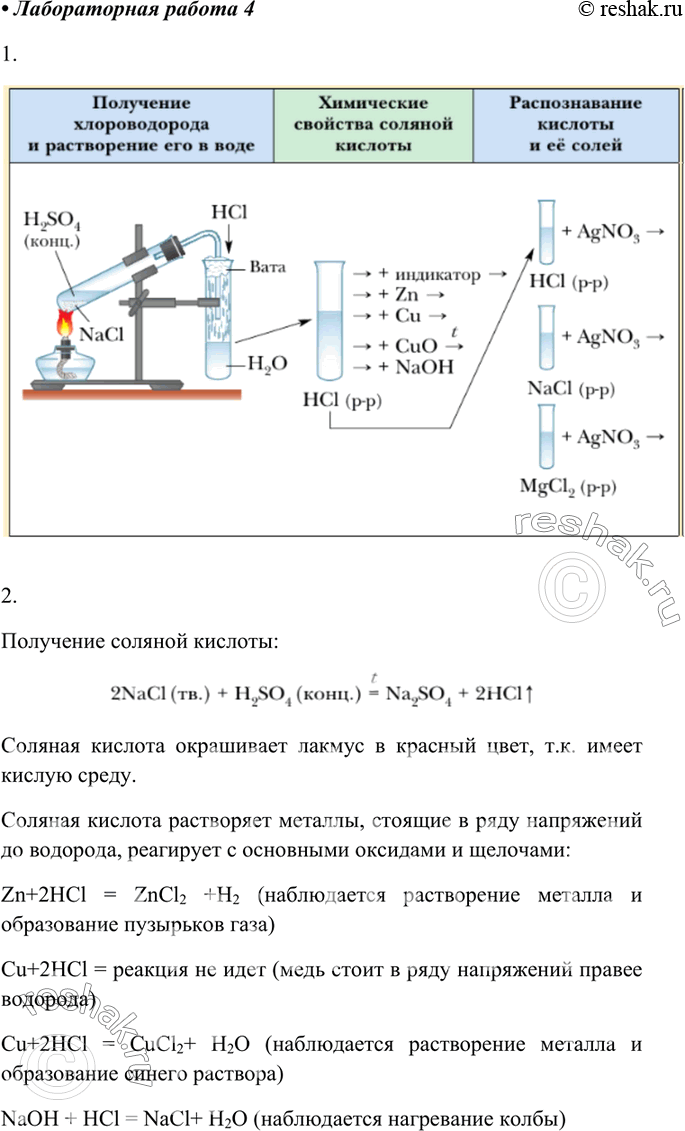

Рассмотрим вариант решения задания из учебника Кузнецова, Титова, Гара 9 класс, Вентана-Граф:
Решение экспериментальных задач по теме «Галогены»
Цель работы: изучить свойства хлороводородной кислоты, научиться отличать хлороводородную кислот и ее соли от других кислот и их солей.
Вспомните правила техники безопасности при работе с кислотами, щелочами, а также с нагревательными приборами.
Ход работы
1. Рассмотрите схему проведения практической работы, определите последовательность своих действий, приготовьте необходимые реактивы и оборудование для изучения свойств хлороводородной кислоты.
2. Выполните опыты. Сделайте выводы: со всеми ли металлами реагирует соляная кислота? Что является реактивом на хлорид-ион?
3. Выполните но вариантам следующие задания:
а) проверьте, имеется ли примесь хлорида натрия в нитрате натрия;
б) обнаружьте примесь иодида калия в хлориде калия;
в) докажите опытным путём, что выданное вещество — бромид, хлорид, йодид.
4. В тетради оформите отчёт о практической работе в форме таблицы. Сделайте выводы.
Получение соляной кислоты:
Соляная кислота окрашивает лакмус в красный цвет, т.к. имеет кислую среду.
Соляная кислота растворяет металлы, стоящие в ряду напряжений до водорода, реагирует с основными оксидами и щелочами:
Zn+2HCl = ZnCl2 +H2 (наблюдается растворение металла и образование пузырьков газа)
Cu+2HCl = реакция не идет (медь стоит в ряду напряжений правее водорода)
Cu+2HCl = CuCl2+ H2O (наблюдается растворение металла и образование синего раствора)
NaOH + HCl = NaCl+ H2O (наблюдается нагревание колбы)
Подтвердить образование хлоридов в вышеперечисленных реакциях можно, добавив качественный реагент на хлориды – нитрат серебра – выпадает белый творожистый осадок хлорида серебра:
ZnCl2 + 2AgNO3 = Zn(NO3)2+2AgClv
CuCl2+ 2AgNO3 = Cu(NO3)2+2AgClv
NaCl+AgNO3 =NaNO3+AgClv
3.
А) Если в нитрате натрия имеется примесь хлорида, то при добавлении нитрата серебра выпадет белый творожистый осадок хлорида серебра:
NaCl+AgNO3 =NaNO3+AgClv
Б) Если в хлориде калия имеется примесь иодида калия, то при добавлении к раствору хлорида калия крахмала, будет наблюдаться синее окрашивание (крахмал – качественный реагент на иод).
В)
Cl-+AgNO3 =NO3-+AgClv (белый осадок)
Br-+AgNO3 =NO3-+AgBrv (светло-желтый осадок)
I-+AgNO3 =NO3-+AgIv (желтый осадок)
Таким образом, качественный реагент на галогениды – нитрат серебра.
Популярные решебники 9 класс Все решебники
*размещая тексты в комментариях ниже, вы автоматически соглашаетесь с пользовательским соглашением





