Параграф 8 Вопрос 5 ГДЗ Еремин Кузьменко 9 класс (Химия)
Решение #1

Рассмотрим вариант решения задания из учебника Еремин, Кузьменко 9 класс, Просвещение:
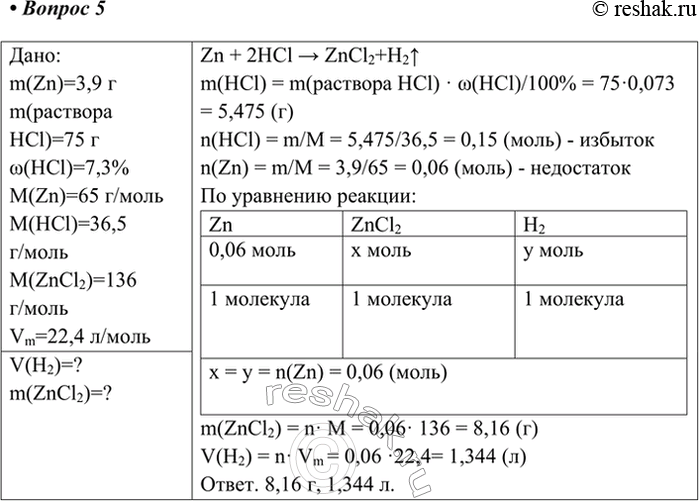
5. Кусочек цинка массой 3,9 г растворили в 75 г 7,3%-й соляной кислоты. Найдите массу образовавшегося хлорида цинка и объём выделившегося водорода (н. у.).
Дано:
m(Zn)=3,9 г
m(раствора HCl)=75 г
w(HCl)=7,3%
M(Zn)=65 г/моль
M(HCl)=36,5 г/моль
M(ZnCl2)=136 г/моль
Vm=22,4 л/моль
V(H2)=?
m(ZnCl2)=?
Zn + 2HCl > ZnCl2+H2^
m(HCl) = m(раствора HCl) · w(HCl)/100% = 75·0,073 = 5,475 (г)
n(HCl) = m/M = 5,475/36,5 = 0,15 (моль) - избыток
n(Zn) = m/M = 3,9/65 = 0,06 (моль) - недостаток
По уравнению реакции:
Zn ZnCl2 H2
0,06 моль x моль y моль
1 молекула 1 молекула 1 молекула
x = y = n(Zn) = 0,06 (моль)
m(ZnCl2) = n· M = 0,06· 136 = 8,16 (г)
V(H2) = n· Vm = 0,06 ·22,4= 1,344 (л)
Ответ. 8,16 г, 1,344 л.
Популярные решебники 9 класс Все решебники
*размещая тексты в комментариях ниже, вы автоматически соглашаетесь с пользовательским соглашением





