Вопрос 1 Параграф 36 ГДЗ Рудзитис 9 класс (Химия)
Решение #1

Рассмотрим вариант решения задания из учебника Рудзитис, Фельдман 9 класс, Просвещение:
Практическая работа 6
Получение оксида углерода( IV) и изучение его свойств. Распознавание карбонатов
1. Получение оксида углерода(IV) и изучение его свойств
1) Поместите в пробирку несколько кусочков мела или мрамора и прилейте немного разбавленной соляной кислоты. Пробирку быстро закройте пробкой с газоотводной трубкой. Конец трубки поместите в другую пробирку, в которой находится 2—3 мл известковой воды. Несколько минут пропускайте выделяющийся газ через известковую воду.
Что происходит, если на мел (мрамор) действуют соляной кислотой?
Почему при пропускании образующегося газа через раствор известковой воды сначала происходит помутнение, а затем взвесь растворяется?
2) Конец газоотводной трубки выньте из раствора и сполосните в дистиллированной воде. Поместите трубку в пробирку с 2—3 мл дистиллированной воды и пропустите через нес выделяющийся газ. Через несколько минут выньте трубку из раствора и добавьте к нему несколько капель синего лакмуса. Что наблюдаете?
3) В пробирку налейте 2—3 мл разбавленного раствора гидроксида натрия, добавьте к нему несколько капель фенолфталеина и затем через раствор пропустите выделяющийся газ. Что наблюдаете?
Напишите уравнения всех проведённых реакций в молекулярном, ионном и сокращённом ионном виде.
2. Распознавание карбонатов
В трех пробирках даны кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия. Определите, какое вещество находится в каждой пробирке.
Сделайте вывод, что является качественной реакцией на карбонат-ионы. Напишите соответствующее уравнение реакции.
3. Отчёт о работе оформите в виде таблицы (см. § 16).
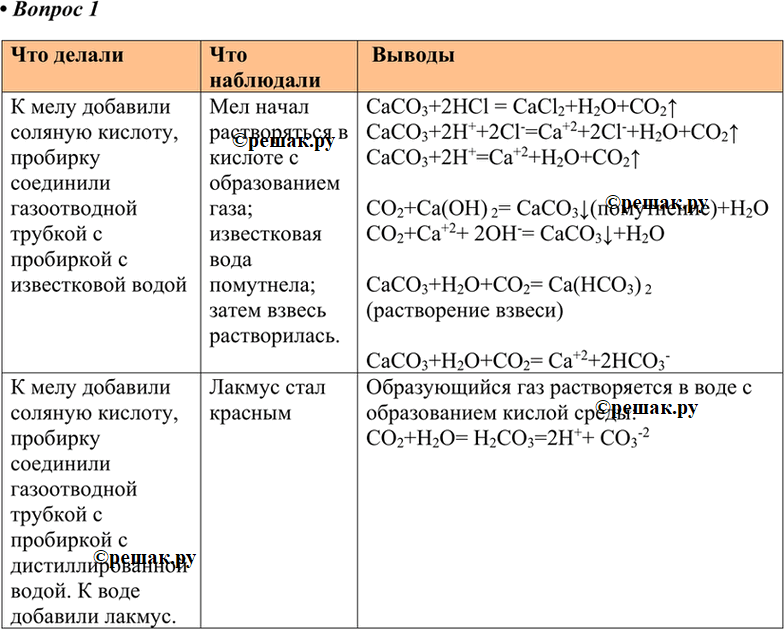
К мелу добавили соляную кислоту, пробирку соединили газоотводной трубкой с пробиркой с известковой водой Мел начал растворяться в кислоте с образованием газа; известковая вода помутнела; затем взвесь растворилась.
CaCO3+2HCl = CaCl2+H2O+CO2^
CaCO3+2H++2Cl-=Ca+2+2Cl-+H2O+CO2^
CaCO3+2H+=Ca+2+H2O+CO2^
CO2+Ca(OH) 2= CaCO3v(помутнение)+H2O
CO2+Ca+2+ 2OH-= CaCO3v+H2O
CaCO3+H2O+CO2= Ca(HCO3) 2 (растворение взвеси)
CaCO3+H2O+CO2= Ca+2+2HCO3-
К мелу добавили соляную кислоту, пробирку соединили газоотводной трубкой с пробиркой с дистиллированной водой. К воде добавили лакмус.
Лакмус стал красным
Образующийся газ растворяется в воде с образованием кислой среды:
CO2+H2O= H2CO3=2H++ CO3-2
К мелу добавили соляную кислоту, пробирку соединили газоотводной трубкой с пробиркой со щелочью и фенолфталеином.
Фенолфталеин, который в растворе щелочи был малиновым, после пропускания газа обесцветился.
Углекислый газ нейтрализует щелочную среду, за счет чего окраска индикатора меняется:
CO2+2NaOH= Na2CO3+H2O
CO2+2Na++ 2OH-=2Na++ CO3-2+H2O
CO2+2OH-= CO3-2+H2O
В пробирки с сульфатом натрия, хлоридом цинка и карбонатом калия добавили хлорид бария и соляную кислоту. В пробирке с сульфатом натрия после добавления хлорида бария выпал белый осадок; в пробирке с карбонатом калия после добавления соляной кислоты образовался газ.
Na2SO4+BaCl2 = BaSO4v(белый осадок)+2NaCl
2Na++ SO4-2+Ba+2+2Cl-= BaSO4v+2Na++2Cl-
Ba+2+ SO4-2= BaSO4v
K2CO3 + 2HCl =2 KCl+H2O+CO2^ - выделение пузырьков газа
2K++CO32-+2H++2Cl-=2K++2Cl-+ H2O+CO2^
2H++ CO32-= H2O+CO2^
Таким образом, качественным реагентом на CO32- -анионы является катион H+ в составе кислоты.
Популярные решебники 9 класс Все решебники
*размещая тексты в комментариях ниже, вы автоматически соглашаетесь с пользовательским соглашением





