Часть C Готовимся к ЕГЭ ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1
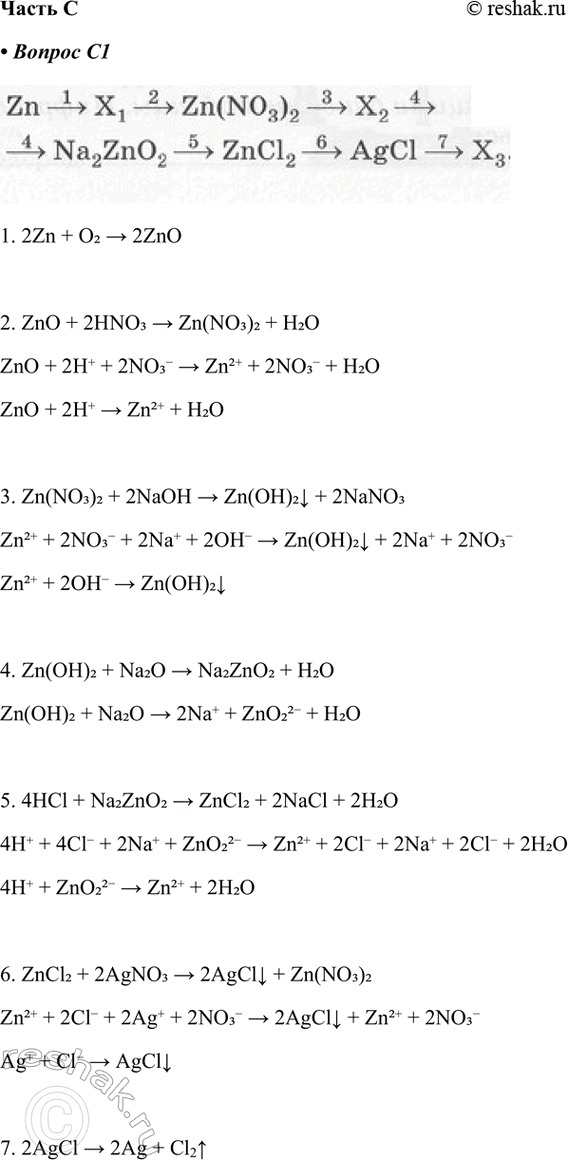


Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
Часть С
Запишите сначала номер задания (С1, С2 или СЗ), а затем развёрнутый ответ к нему.
С1. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для всех превращений, кроме первого и последнего, составьте сокращённые ионные уравнения реакций.
1. 2Zn + O2 > 2ZnO
2. ZnO + 2HNO3 > Zn(NO3)2 + H2O
ZnO + 2H+ + 2NO3- > Zn2+ + 2NO3- + H2O
ZnO + 2H+ > Zn2+ + H2O
3. Zn(NO3)2 + 2NaOH > Zn(OH)2v + 2NaNO3
Zn2+ + 2NO3- + 2Na+ + 2OH- > Zn(OH)2v + 2Na+ + 2NO3-
Zn2+ + 2OH- > Zn(OH)2v
4. Zn(OH)2 + Na2O > Na2ZnO2 + H2O
Zn(OH)2 + Na2O > 2Na+ + ZnO22- + H2O
5. 4HCl + Na2ZnO2 > ZnCl2 + 2NaCl + 2H2O
4H+ + 4Cl- + 2Na+ + ZnO22- > Zn2+ + 2Cl- + 2Na+ + 2Cl- + 2H2O
4H+ + ZnO22- > Zn2+ + 2H2O
6. ZnCl2 + 2AgNO3 > 2AgClv + Zn(NO3)2
Zn2+ + 2Cl- + 2Ag+ + 2NO3- > 2AgClv + Zn2+ + 2NO3-
Ag+ + Cl- > AgClv
7. 2AgCl > 2Ag + Cl2^
С2. Для определения качественного состава неизвестной соли учащимся выдали белое кристаллическое вещество, хорошо растворимое в воде, известное как «пекарский порошок». Часть выданной соли смешали с твёрдой щёлочью и смесь нагрели. При этом выделился газ с резким запахом. Другую часть соли растворили в воде и к полученному раствору прилили прозрачный раствор кислоты. Смесь «вскипела», так как в результате реакции выделился газ. Запишите химическую формулу и название выданной соли. Составьте два уравнения реакций, которые были проведены в процессе её распознавания, в молекулярной и ионной формах.
Исследуемый «пекарский порошок» - это карбонат аммония (NH4)2CO3:
(NH4)2CO3 + 2KOH > 2NH3^ (газ с резким запахом) + 2H2O + K2CO3
2NH4+ + CO32- + 2K+ + 2OH- > 2NH3^+ 2H2O + 2K+ + CO32-
NH4+ + OH- > NH3^+ H2O
(NH4)2CO3 + 2HCl > 2NH4Cl + H2O + CO2^ («вскипание» раствора)
2NH4+ + CO32- + 2H+ + 2Cl- > 2NH4+ + 2Cl- + H2O + CO2^
CO32- + 2H+ > H2O + CO2^
СЗ. 640 г раствора сульфата меди (II) смешали с избытком раствора гидроксида натрия. Выпал осадок массой 14,7 г. Вычислите массовую долю соли в исходном растворе.
Дано:
m(Cu(OH)2)=14,7 г
M(Cu(OH)2)= 98 г/моль
M(CuSO4)= 160 г/моль
m(CuSO4 технич.)=640 г
w(CuSO4)=?
CuSO4 + 2NaOH > Cu(OH)2v + Na2SO4
n(Cu(OH)2)=m/M=14,7/98=0,15 (моль)
x=n(CuSO4)= 0,15·1/1= 0,15 (моль)
m(CuSO4)= n· M=0,15· 160= 24 (г)
w(CuSO4)= m(CuSO4) / m(CuSO4 технич.) = 24 / 640 = 0,0375 = 3,75%
Ответ. 3,75%.
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









