Часть II Параграф 3 ГДЗ Рабочая тетрадь Габриелян 9 класс (Химия)
Решение #1

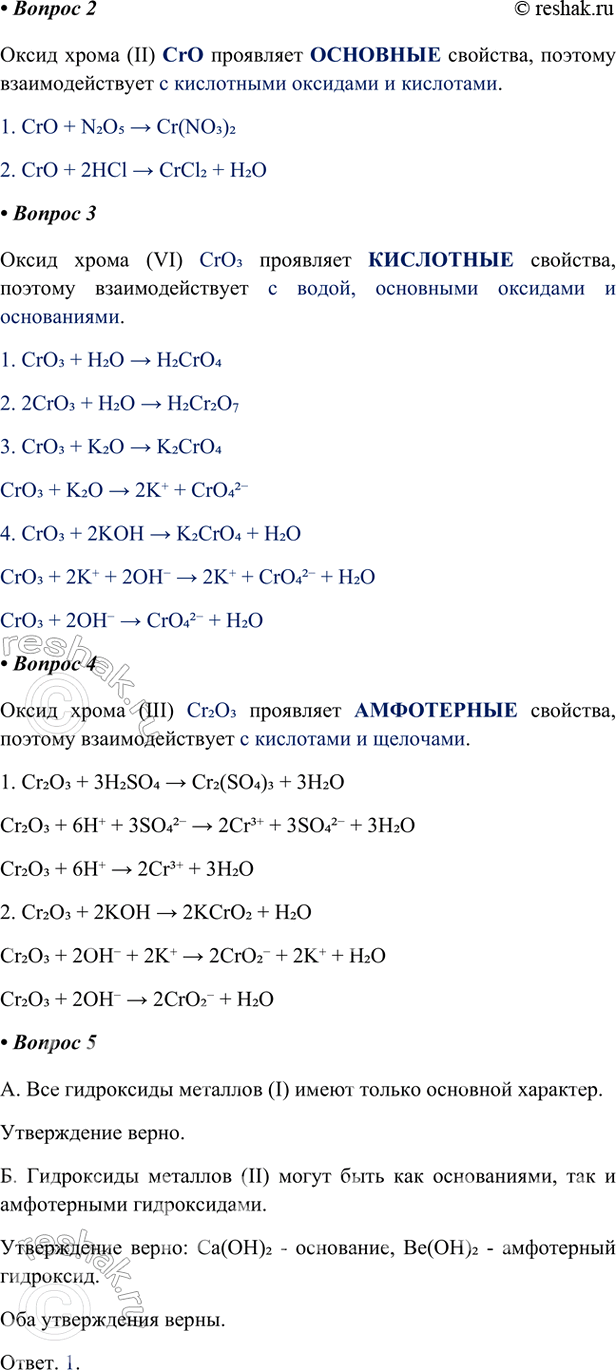


Рассмотрим вариант решения задания из учебника Габриелян, Сладков 9 класс, Дрофа:
Часть II
1. Дайте характеристику элемента алюминия по плану, с которым вы познакомились на первых уроках:
Характеристика алюминия
1) Al – это элемент IIIА группы 3-го МАЛОГО периода.
2) 13Al 2e, 8e, 3e
3) Это ВОССТАНОВИТЕЛЬ, который получает с.о. +3.
4-5) Al – это МЕТАЛЛ, поэтому имеет МЕТАЛЛИЧЕСКУЮ кристаллическую решетку, образованную за счет МЕТАЛЛИ-ЧЕСКОЙ химической связи, схема которой:
Al0 -3e > Al+3
6) АЛЛОТРОПИЯ для алюминия нехарактерна.
7) Как металл Al < активный, чем Mg, но > активен, чем Si.
8) Как металл, Al > активный, чем B, но < , чем Ga.
9) Оксид алюминия Al2O3 имеет АМФОТЕРНЫЙ характер, поэтому взаимодействует и с КИСЛОТОЙ, и с ЩЕЛОЧЬЮ, образуя соль и воду.
10) Амфотерный гидроксид Al(OH)3 является и основанием, и КИСЛОТОЙ, которая имеет формулу H3AlO3.
Al(OH)3 взаимодействует:
С кислотами:
2Al(OH)3 + 3H2SO4 > Al2(SO4)3 + 6H2O
2Al(OH)3 + 6H+ + 3SO42- > 2Al3+ + 3SO42- + 6H2O
Al(OH)3 + 3H+ > Al3+ + 3H2O
И с щелочами:
Al(OH)3 + 3KOH > K3AlO3 + 3H2O
Al(OH)3 + 3K+ + 3OH- > 3K+ + AlO33- + 3H2O
Al(OH)3 + 3OH- > AlO33- + 3H2O
2. Оксид хрома (II) CrO проявляет ОСНОВНЫЕ свойства, поэтому взаимодействует с кислотными оксидами и кислотами.
1. CrO + N2O5 > Cr(NO3)2
2. CrO + 2HCl > CrCl2 + H2O
Приведите уравнения соответствующих реакций.
3. Оксид хрома (VI) CrO3 проявляет КИСЛОТНЫЕ свойства, поэтому взаимодействует с водой, основными оксидами и основаниями.
1. CrO3 + H2O > H2CrO4
2. 2CrO3 + H2O > H2Cr2O7
3. CrO3 + K2O > K2CrO4
CrO3 + K2O > 2K+ + CrO42-
4. CrO3 + 2KOH > K2CrO4 + H2O
CrO3 + 2K+ + 2OH- > 2K+ + CrO42- + H2O
CrO3 + 2OH- > CrO42- + H2O
Приведите уравнения соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
4. Оксид хрома (III) Cr2O3 проявляет АМФОТЕРНЫЕ свойства, поэтому взаимодействует с кислотами и щелочами.
1. Cr2O3 + 3H2SO4 > Cr2(SO4)3 + 3H2O
Cr2O3 + 6H+ + 3SO42- > 2Cr3+ + 3SO42- + 3H2O
Cr2O3 + 6H+ > 2Cr3+ + 3H2O
2. Cr2O3 + 2KOH > 2KCrO2 + H2O
Cr2O3 + 2OH- + 2K+ > 2CrO2- + 2K+ + H2O
Cr2O3 + 2OH- > 2CrO2- + H2O
Приведите уравнения соответствующих реакций в молекулярной, полной и сокращённой ионной формах.
5. Верны ли следующие суждения?
А. Все гидроксиды металлов (I) имеют только основной характер.
Утверждение верно.
Б. Гидроксиды металлов (II) могут быть как основаниями, так и амфотерными гидроксидами.
Утверждение верно: Ca(OH)2 - основание, Be(OH)2 - амфотерный гидроксид.
Оба утверждения верны.
Ответ. 1.
6. Верны ли следующие суждения?
А. Характер гидроксидов переходных металлов VIB и VIIB групп зависит от с. о. металлов:
– с низшей с. о. – носит ОСНОВНЫЙ характер;
– с промежуточной с. о. – АМФОТЕРНЫЙ характер;
– с высшей с. о. – КИСЛОТНЫЙ характер.
Утверждение верно.
Б. Оксиды и гидроксиды неметаллов всегда имеют кислотный характер.
Утверждение неверно.
Верно только А.
Ответ. 2.
7. Формула высшего оксида марганца Mn2O7, а формула его гидроксида – HMnO4. Оба соединения имеют КИСЛОТНЫЙ характер.
Для оксида марганца (VII):
1) Mn2O7 + K2O > 2KMnO4
2) Mn2O7 + 2KOH > 2KMnO4 + H2O
Mn2O7 + 2OH- + 2K+ > 2K+ + 2MnO4- + H2O
Mn2O7 + 2OH- > 2MnO4- + H2O
Для марганцовой кислоты:
1) 2HMnO4 + K2O > 2KMnO4 + H2O
2H+ + 2MnO4- + K2O > 2K+ + 2MnO4- + H2O
2H+ + K2O > 2K+ + H2O
2) HMnO4 + KOH > KMnO4 + H2O
H+ + MnO4- + K+ + OH- > K+ + MnO4- + H2O
H+ + OH- > H2O
Похожие решебники
Популярные решебники 9 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









