Часть II Параграф 10 ГДЗ Рабочая тетрадь Габриелян Остроумов 11 класс (Химия)



Рассмотрим вариант решения задания из учебника Габриелян, Остроумов, Сладков 11 класс, Просвещение:
Часть II
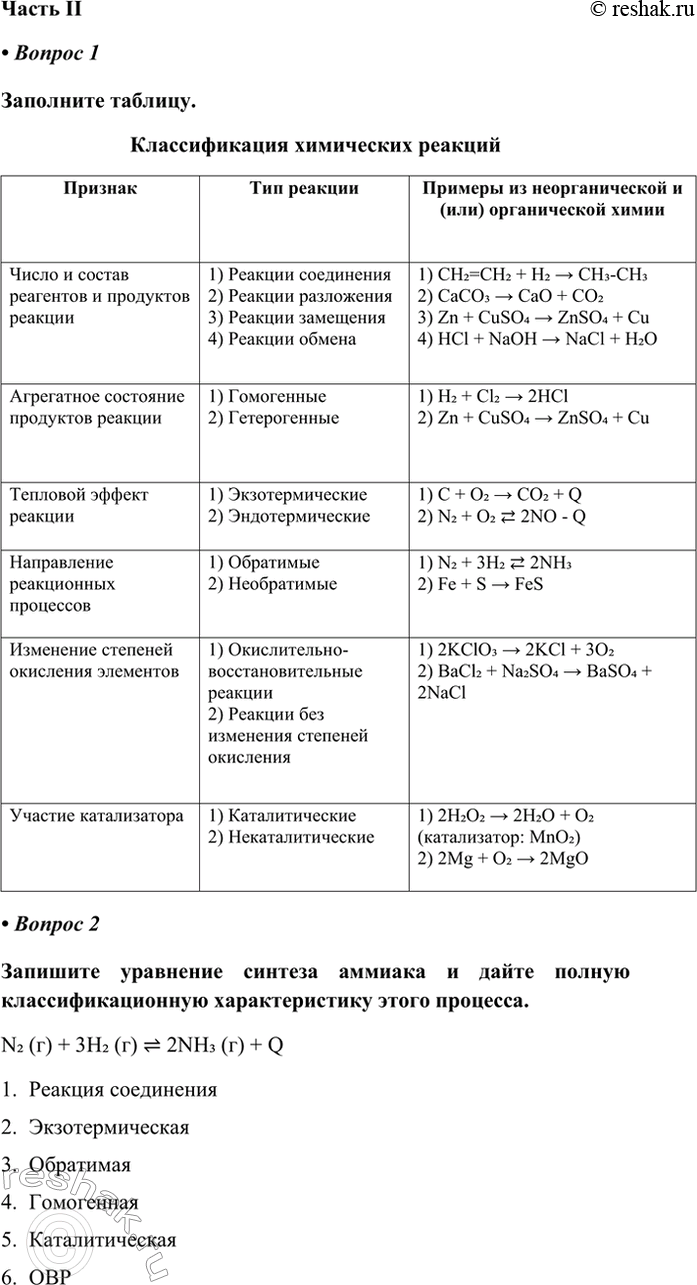
• Вопрос 1
Заполните таблицу.
Классификация химических реакций
• Вопрос 2
Запишите уравнение синтеза аммиака и дайте полную классификационную характеристику этого процесса.
N2 (г) + 3H2 (г) < - > 2NH3 (г) + Q
1. Реакция соединения
2. Экзотермическая
3. Обратимая
4. Гомогенная
5. Каталитическая
6. ОВР
• Вопрос 3
Запишите уравнение дегидратации этилена и дайте полную классификационную характеристику этого процесса.
В задании ошибка, потому что этилен не дегидратируется (в нем нет кислорода).
Реакция гидратации этилена:
1. Реакция соединения
2. Экзотермическая
3. Обратимая
4. Гетерогенная
5. Каталитическая
6. Не ОВР
• Вопрос 4
Напишите уравнения реакций, с помощью которых можно осуществить превращения, дайте названия соединений и реакций.
C2H2 > C2H4 > C2H5OH > C2H4 > C2H5Br > C2H4 > (-CH2-CH2-)n
1. Гидрирование ацетилена:
HC=CH (ацетилен) + H2 (водород) > H2C=CH2 (этилен)
2. Гидратация этилена:
CH2=CH2 (этилен) + H2O (вода) > CH3CH2OH (этанол)
3. Дегидратация этанола:
CH3CH2OH (этанол) > CH2=CH2 (этилен) + H2O (вода)
4. Гидрогалогенирование этилена:
CH2=CH2 (этилен) + HBr (бромоводород) > CH3CH2Br (бромэтан)
5. Дегидрогалогенирование бромэтана:
CH3CH2Br (бромэтан) > CH2=CH2 (этилен) + HBr (бромоводород)
6. Полимеризация этилена:
nCH2=CH2 (этилен) > [-CH2-CH2-]n (полиэтилен)
• Вопрос 5
Запишите уравнения реакций, с помощью которых можно осуществить превращения, дайте названия соединений и реакций.
Li > Li2O > LiOH > Li2CO3 > LiHCO3 > LiCl
1. Горение лития:
4Li (литий) + O2 (кислород) > 2Li2O (оксид лития)
2. Растворение оксида лития:
Li2O (оксид лития) + H2O (вода) > 2LiOH (гидроксид лития)
3. Пропускание углекислого газа через раствор гидроксида лития:
2LiOH (гидроксид лития) + CO2 (углекислый газ) > Li2CO3 (карбонат лития) + H2O (вода)
4. Пропускание углекислого газа через раствор карбоната лития:
Li2CO3 (карбонат лития) + CO2 (углекислый газ) + H2O (вода) > 2LiHCO3 (гидрокарбонат лития)
5. Реакция гидрокарбоната лития с соляной кислотой:
LiHCO3 (гидрокарбонат лития) + HCl (соляная кислота) > LiCl (хлорид лития) + H2O (вода) + CO2^ (углекислый газ)
• Вопрос 6
Термохимическое уравнение реакции горения ацетилена
2C2H2 + 5O2 > 4CO2^ + 2H2O + 2610 кДж
Какое количество теплоты выделится при сгорании ацетилена, полученного из 348 г карбида кальция, содержа-щего 8% примесей?
Дано:
m(CaC2 техн.)=348 г
M(CaC2)= 64 г/моль
w(прим.)=8%
Q =?
CaC2 + 2H2O > C2H2 + Ca(OH)2
w(CaC2) = 100% - w(прим.) = 100%-8% = 92%
m(CaC2)= m(CaC2 техн.) · w(CaC2)/100%=
348 ·0,92=320,16 (г)
n(CaC2)=m/M=320,16/64 =5 (моль)
По уравнению реакции:
CaC2 C2H2
5 моль x моль
1 молекула 1 молекула
x=n(C2H2)= 5 (моль)
2C2H2 + 5O2 > 4CO2^ + 2H2O + 2610 кДж
По уравнению реакции:
C2H2 Q
5 моль x кДж
2 молекулы 2610 кДж
x= Q = 5·2610 /2=6525 (кДж)
Ответ. 6525 кДж.
• Вопрос 7
К эндотермическим процессам относится
1) гашение извести
2) обжиг известняка
3) нейтрализация фосфорной кислоты известковым молоком
4) помутнение известковой воды
Эндотермические процессы – почти всегда реакции разложения; среди представленных реакций только одна реакция разложения – обжиг известняка.
Ответ. 2.
• Вопрос 8
К окислительно-восстановительным реакциям не относятся:
1) реакции замещения
2) реакции соединения с участием простых веществ
3) реакции разложения с участием простых веществ
4) реакции обмена
Поясните свой выбор.
Ответ. 4.
Реакции 1-2 сопровождаются превращениями простых веществ, т.е. степень окисления меняется с 0 на ненулевое значение. Реакции 3 приводят к образованию простых веществ, т.е. степень окисления меняется с ненулевого значения на 0. Поэтому реакции 1-3 – ОВР.
В реакциях обмена с участием ионов не происходит изменения степеней окисления, т.к. ионы при этом не изменяются:
Ag+N+5O3-2 + H+Cl- > Ag+Cl-v + H+N+5O3-2
Похожие решебники
Популярные решебники 11 класс Все решебники
*К сожалению, временные проблемы с публикацией комментариев с мобильных устройств.









