Практическая работа 5 ГДЗ Кузнецова Титова 9 класс (Химия)
Решение #1

Рассмотрим вариант решения задания из учебника Кузнецова, Титова, Гара 9 класс, Вентана-Граф:
Получение аммиака и изучение его свойств
Оборудование: штатив с лапкой; спиртовка (горелка); пробка с газоотводной трубкой; стеклянная лопаточка (шпатель); фарфоровая ступка; стеклянная палочка; стакан или кристаллизатор, наполненный водой; лучинки; ватный тампон; сухие пробирки.
Реактивы: лакмусовая бумажка (или фенолфталеин); хлорид аммония; гидроксид кальция (гашёная известь); раствор аммиака (1%-й); раствор соляной кислоты (1 : 3); раствор серной кислоты (1 : 5).
При выполнении опытов необходимо соблюдать правила техники безопасности, для чего вспомните:
1) правила обращения со спиртовкой п нагревания жидкостей;
2) правила обращения с кислотами и аммиаком;
3) правила дозирования и приливания (добавления) веществ;
4) правила определения запаха газа;
5) правила уборки и утилизации отходов.
Ход работы
1. Получение аммиака и растворение его в воде.
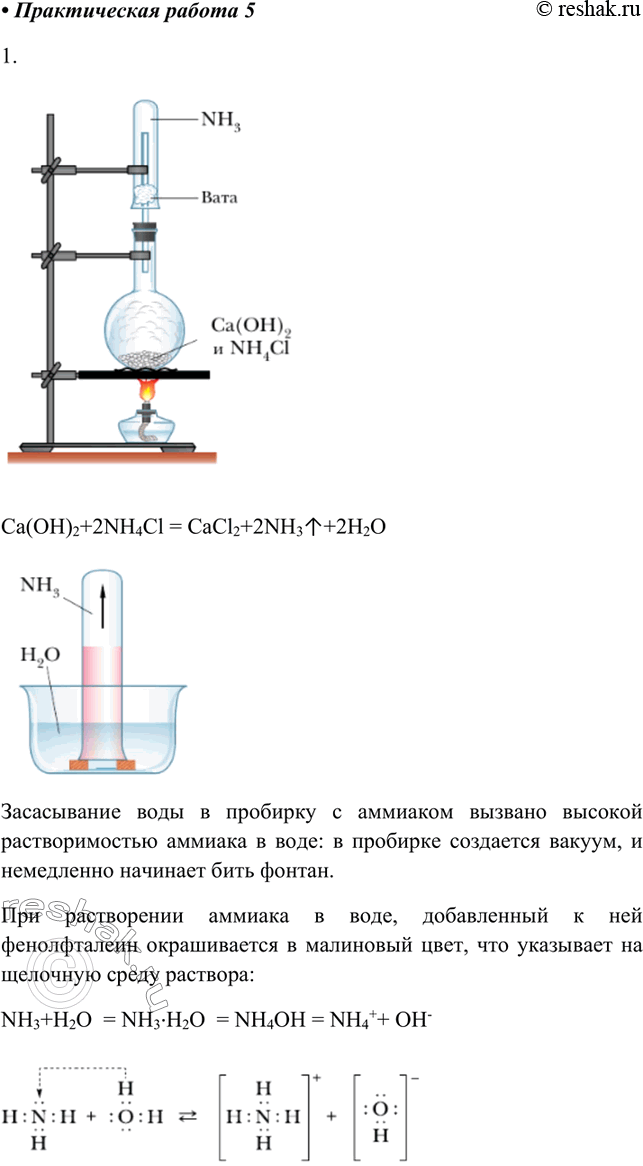
В фарфоровой ступке хорошо перемешайте равные объёмы твёрдых хлоридов аммония и гидроксида кальция. Веществ возьмите столько, чтобы смесью их можно было заполнить пробирку. Засыпьте смесь в пробирку и закройте её пробкой с газоотводной трубкой. Закрепите пробирку наклонно к ланке штатива так, чтобы пробка была несколько ниже дна пробирки.
Наденьте на свободный конец трубки сухую пробирку, закрыв снизу её отверстие ватным тампоном. Начните нагревать смесь. Сначала прогрейте всю пробирку, а затем то место, где находится смесь. Обратите внимание на конденсацию паров воды у пробки. Когда почувствуете запах, заткните пробирку пальцем и, не переворачивая, погрузите пробирку с газом в стакан или кристаллизатор с водой.
Наблюдайте быстрое засасывание воды в пробирку. Чем вызвано это явление?
Переверните пробирку с раствором п испытайте раствор лакмусовой или фенолфталеиновой бумажкой. Что наблюдаете? Какой вывод можно сделать?
2. Взаимодействие аммиака с кислотами.
Снова слегка нагрейте смесь хлорида аммония с гидроксидом кальция, переверните газоотводную трубку вниз и попеременно опускайте её в пробирки, на У4 заполненные растворами соляной и серной кислот, но не касайтесь их газоотводной трубкой. Что наблюдаете? Во всех пробирках над поверхностью растворов кислот образуется «белый дым», состоящий из твёрдых частиц. На кончике газоотводной трубки видны кристаллики солей. Что произошло? Какие продукты образовались?
Запишите уравнения возможных реакций и сделайте выводы относительно свойств аммиака и его водного раствора.
3. Взаимодействие солей аммония со щелочами
(распознавание солей аммония).
В одну пробирку поместите немного кристаллического сульфата аммония, в другую — нитрата аммония. В обе пробирки прилейте по 1—2 мл раствора гидроксида натрия и слегка нагрейте. Выделяется газ с резким запахом. Это уже знакомый вам аммиак. Поднесите к отверстию этих пробирок лакмусовую бумажку, смоченную в дистиллированной воде. Лакмус синеет.
Запишите уравнения реакций и сделайте выводы относительно распознавания солей аммония среди других веществ.
Ca(OH)2+2NH4Cl = CaCl2+2NH3^+2H2O
Засасывание воды в пробирку с аммиаком вызвано высокой растворимостью аммиака в воде: в пробирке создается вакуум, и немедленно начинает бить фонтан.
При растворении аммиака в воде, добавленный к ней фенолфталеин окрашивается в малиновый цвет, что указывает на щелочную среду раствора:
NH3+H2O = NH3·H2O = NH4OH = NH4++ OH-
2.
Во всех пробирках образовался белый дым, а на кончике газоотводной трубки появились кристаллы белого цвета. Это происходит из-за образования солей аммония:
NH3+HCl = NH4Cl (хлорид аммония)
2NH3+H2SO4 = (NH4)2SO4 (сульфат аммония)
Таким образом, аммиак и его водный раствор проявляют основные свойства.
3.
При реакции солей аммония с гидроксидом натрия выделяется аммиак, который можно распознать по характерному запаху, а также по посинению лакмусовой бумажки (раствор аммиака дает щелочную среду):
(NH4)2SO4+2NaOH = Na2SO4 +2NH3+2 H2O
NH4NO3+NaOH = NaNO3 +NH3+H2O
Таким образом, качественной реакцией на соли аммония является взаимодействие со щелочью, приводящее к образованию легко распознаваемого аммиака.
Популярные решебники 9 класс Все решебники
*размещая тексты в комментариях ниже, вы автоматически соглашаетесь с пользовательским соглашением





