Вопрос 1 Параграф 22 ГДЗ Рудзитис 9 класс (Химия)
Решение #1


Рассмотрим вариант решения задания из учебника Рудзитис, Фельдман 9 класс, Просвещение:
Практическая работа 4
Решение экспериментальных задач по теме «Кислород и сера»
вспомните правила техники безопасности при работе в химическом кабинете.
Составьте план работы.
Определите перечень необходимых реактивов и оборудования.
Для решения задачи берите не всё вещество, а порцию (пробу) — примерно 1 см3.
Чтобы не перепутать пробы, ставьте пробирки с растворами одну за другой в штатив для пробирок и нумеруйте с помощью специального карандаша.
Задача 1. Даны пробирки с растворами: а) сульфата натрия; б) хлорида натрия; в) серной кислоты. Опытным путём определите, в какой пробирке находится каждое из указанных веществ.
Задача 2. Дан раствор сульфата меди(Л). Получите из него раствор хлорида меди(II).
Задача 3. Даны четыре пронумерованные пробирки, в которых находятся следующие соли калия: сульфид, сульфат, сульфит, бромид. Определите при помощи характерных реакций каждое из данных веществ.
Задача 4. Проделайте опыты но осуществлению следующих превращений:
а) цинк -> сульфат цинка —> гидроксид цинка
б) оксид меди(II) —сульфат меди(II) —> гидроксид меди(II)
Задача 5. Даны вещества: серная кислота, цинк, растворы нитрата стронция, хлорида натрия, хлорида кальция, хлорида меди(II). Проверьте опытным путём, с какими веществами реагирует серная кислота. Почему? Какие реакции относятся к окислительно-восстановительным? Ответ мотивируйте.
Задача 6. Проделайте реакции, подтверждающие качественный состав серной и соляной кислот.
4. Отчёт о работе оформите в виде таблицы (см. § 16).
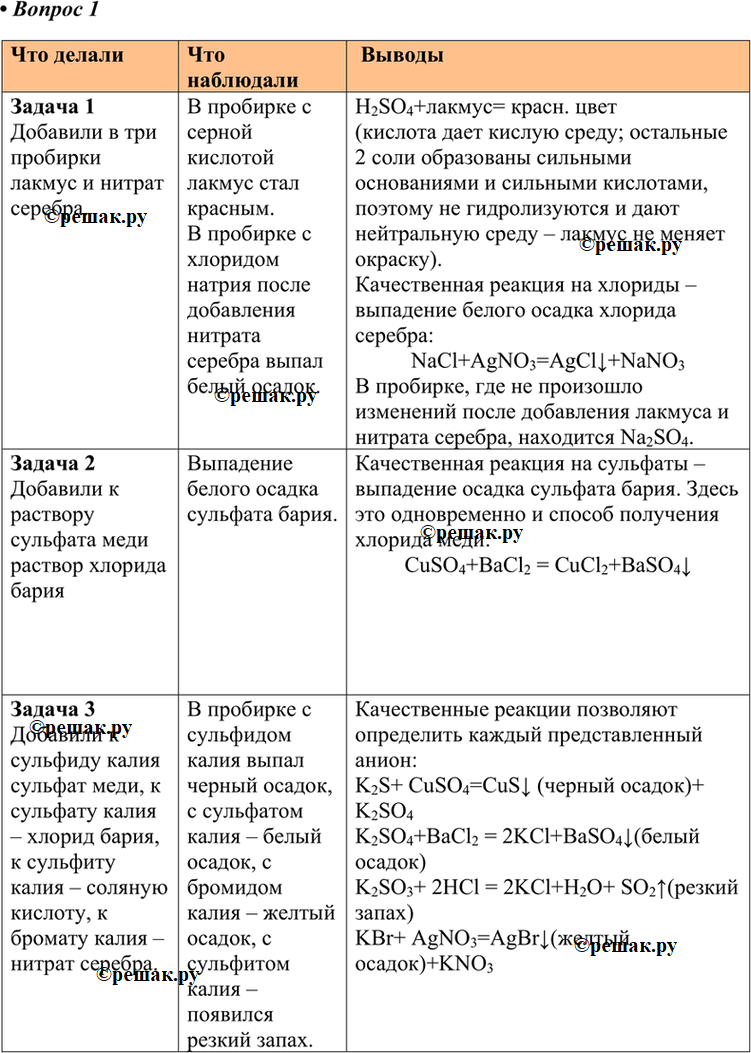
Задача 1
Добавили в три пробирки лакмус и нитрат серебра.
В пробирке с серной кислотой лакмус стал красным.
В пробирке с хлоридом натрия после добавления нитрата серебра выпал белый осадок.
H2SO4+лакмус= красн. цвет
(кислота дает кислую среду; остальные 2 соли образованы сильными основаниями и сильными кислотами, поэтому не гидролизуются и дают нейтральную среду – лакмус не меняет окраску).
Качественная реакция на хлориды – выпадение белого осадка хлорида серебра:
NaCl+AgNO3=AgClv+NaNO3
В пробирке, где не произошло изменений после добавления лакмуса и нитрата серебра, находится Na2SO4.
Задача 2
Добавили к раствору сульфата меди раствор хлорида бария
Выпадение белого осадка сульфата бария. Качественная реакция на сульфаты – выпадение осадка сульфата бария. Здесь это одновременно и способ получения хлорида меди:
CuSO4+BaCl2 = CuCl2+BaSO4v
Задача 3
Добавили к сульфиду калия сульфат меди, к сульфату калия – хлорид бария, к сульфиту калия – соляную кислоту, к бромату калия – нитрат серебра.
В пробирке с сульфидом калия выпал черный осадок, с сульфатом калия – белый осадок, с бромидом калия – желтый осадок, с сульфитом калия – появился резкий запах. Качественные реакции позволяют определить каждый представленный анион:
K2S+ CuSO4=CuSv (черный осадок)+ K2SO4
K2SO4+BaCl2 = 2KCl+BaSO4v(белый осадок)
K2SO3+ 2HCl = 2KCl+H2O+ SO2^(резкий запах)
KBr+ AgNO3=AgBrv(желтый осадок)+KNO3
Задача 4
А) К цинку добавили серную кислоту, а затем гидроксид натрия.
Б) К оксиду меди добавили серную кислоту, а затем гидроксид натрия.
А) После добавления кислоты, образовались пузырьки газа, после добавления щелочи выпал белый осадок.
Б) После добавления кислоты, образовался синий раствор, после добавления щелочи выпал синий осадок.
А) Zn+ H2SO4= ZnSO4+ H2^(пузырьки газа)
ZnSO4+2NaOH=Zn(OH)2v(белый осадок)+Na2SO4
Б) CuO+ H2SO4= CuSO4+H2O (растворение осадка, образование синего раствора)
CuSO4+2NaOH=Cu(OH)2v(синий осадок)+Na2SO4
Задача 5
Добавили к цинку, нитрату стронция, хлориду натрия, хлориду кальция и хлориду меди серную кислоту. С цинком образовались пузырьки газа, с нитратом стронция выпал белый осадок, с хлоридами натрия и меди нет изменений.
Задача 6
Добавили к соляной и серной кислоте лакмус; добавили к соляной кислоте нитрат серебра, к серной – хлорид бария.
Лакмус изменил окраску на красную; после добавления реагентов выпали белые осадки. Красная окраска лакмуса свидетельствует о наличие в составе веществ H+.
Выпадение осадка хлорида серебра свидетельствует о наличии в составе соляной кислоты хлорид-аниона:
HCl+AgNO3=AgClv+ HNO3
Выпадение осадка сульфата бария свидетельствует о наличии в составе серной кислоты сульфат-аниона:
H2SO4+BaCl2 = 2HCl+BaSO4v
*размещая тексты в комментариях ниже, вы автоматически соглашаетесь с пользовательским соглашением





